蛋白质功能
一、蛋白质的主要功能
1.构成细胞和生物体结构
蛋白质是组成人体各种组织、器官、细胞的重要成分。
2.物质运输
体内的各种物质主要通过血液进行运输。人体不断地将从外界获取的营养物质和氧气运输到组织细胞,将代谢产生的废物排出体外。
血红蛋白可以携带氧气到身体的各个部分,供组织细胞代谢使用。
体内有许多营养素必须与某种特异的蛋白质结合,将其作为载体才能运转:
- 例如血液中的载脂蛋白不仅运输脂质,还具有调节脂质代谢的作用。
- 清蛋白能与脂肪酸、Ca2+、胆红素、磺胺等多种物质结合。
- 此外,血浆中还有皮质激素传递蛋白、运铁蛋白、铜蓝蛋白等。
3.催化功能
酶,绝大多数是蛋白质。
4.信息交流
存在于细胞膜上使细胞对外界刺激产生相应的效应的受体是蛋白质。信号转导通路中的衔接蛋白,含有各种能与其他蛋白质结合的结构域,能形成各种信号复合体。通过特异性的蛋白质-蛋白质相互作用形成蛋白质复合体来激活下游信号通路。
5.免疫功能
保护机体抵抗相应病原体的感染的抗体、淋巴因子等免疫分子都是蛋白质。
6.氧化供能
体内的蛋白质可以彻底氧化分解为水、二氧化碳,并释放能量。正常膳食情况下,机体首先利用糖提供能量。饥饿时,组织蛋白质分解增加,故氧化供能是蛋白质的生理功能。
7.维持机体的酸碱平衡
机体内组织细胞必须处于合适的酸碱度范围内,才能完成其正常的生理活动。机体的这种维持酸碱平衡的能力是通过肺、肾以及血液缓冲系统来实现的。蛋白质缓冲体系是血液缓冲系统的重要组成部分。 #生理,病生
8.维持正常的血浆渗透压
血浆胶体渗透压主要由蛋白质分子构成,其中,血浆清蛋白分子量较小,数目较多,决定血浆胶体渗透压的大小。如果血浆蛋白质特别是清蛋白的含量降低,血液内的水分便会过多地渗入周围组织,造成临床上的营养不良性水肿。
二、蛋白质执行功能的主要方式
(一)与小分子相互作用
蛋白质通过与小分子代谢物的相互作用,参与众多的生命活动过程,如酶的催化作用、物质转运、信息传递等。
(二)与核酸相互作用
蛋白质和核酸是组成生物体的两种重要的生物大分子。蛋白质是基因表达的产物,基因的表达又离不开蛋白质的作用。
蛋白质有几种模体,如锌指模体、亮氨酸拉链、螺旋-转角-螺旋等专门结合DNA并发挥生物学效应。
RNA存在于细胞质和细胞核中,目前发现的RNA除了少部分能以“核酶”形式单独发挥功能以外,绝大部分RNA都是与蛋白质形成RNA-蛋白质复合物。
- 例如核糖体是细胞内蛋白质合成的场所,核糖体的两个亚基由精确折叠的蛋白质和rRNA组成;
- [200 学习/201 细胞生物学/第08章 细胞核/第2节 染色质和染色体/染色质和染色体#(五)端粒|端粒酶]是一种由催化蛋白和RNA模板组成的酶,可合成染色体末端的DNA;
- [200 学习/201 细胞生物学/第09章 基因表达/第4节 基因表达的调控/基因表达的调控#3.剪接体和剪接位点|剪接体]是指进行RNA剪接时形成的多组分复合物,主要是由小分子的核RNA和蛋白质组成。
(三)蛋白质相互作用
蛋白质-蛋白质相互作用(protein-protein interaction,PPI)是指两个或两个以上的蛋白质分子通过非共价键相互作用并发挥功能的过程。蛋白质相互作用是蛋白质执行功能的主要方式。
1.主要组织相容性复合物参与的分子识别
主要组织相容性复合物(major histocompatibility complex,MHC)是表达于脊椎动物细胞表面的一类具有高度多态性的蛋白质,分为I型MHC蛋白和Ⅱ型MHC蛋白。
所有I型MHC蛋白为跨膜蛋白,都包含有两条不相连的多肽链,一条为α链,另一条为β2m(β2-微球蛋白)。α链包括4个区域,分别为抗原结合区(α1+α2)(氨基端)、免疫球蛋白样区、跨膜区、胞液区的羧基端。β链与α链的胞膜外部分以非共价键结合,β链不与细胞直接相连(图1-18)。
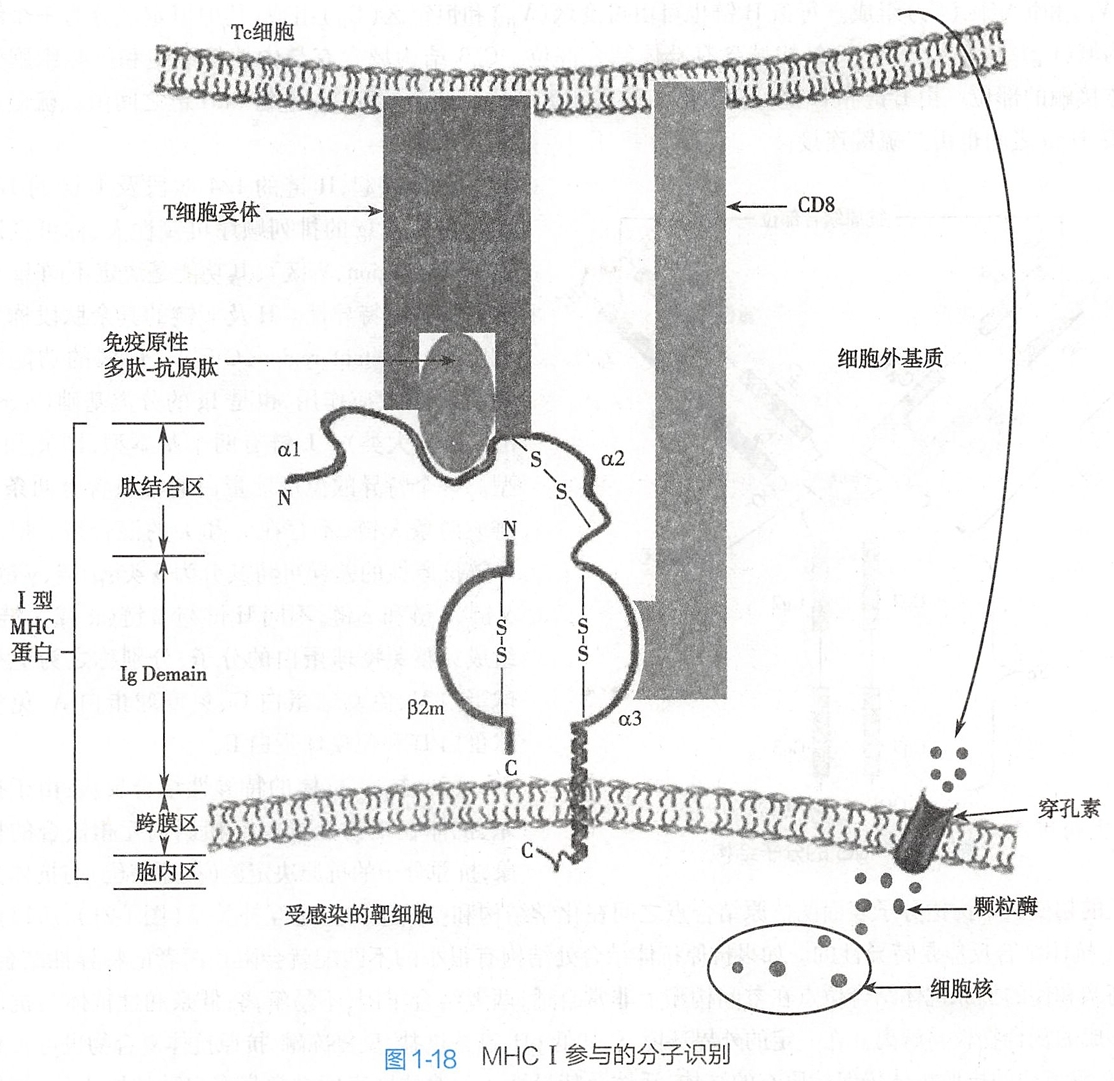
I型MHC蛋白广泛表达于一般细胞表面,如果该细胞遭受病毒感染(受感染靶细胞),则病毒外壳蛋白碎片的免疫原性多肽透过跨膜的MHC提呈在细胞外侧,以便于 T淋巴细胞的识别并执行一系列免疫功能。
T淋巴细胞是人体免疫系统中重要的免疫细胞,种类极多,按功能主要分为两个亚群:Tc细胞(细胞毒性T细胞)及Th细胞(辅助性T细胞)。
Tc细胞能杀伤表达抗原肽的受感染靶细胞。Tc细胞又名为CD8细胞,其表面表达协同受体CD8(跨膜糖蛋白)。Tc细胞表面含有特定的T细胞受体(T cell receptor,TCR)。Tc细胞受体不能单独识别受感染靶细胞表达的免疫原性多肽,但可识别免疫原性多肽与MHC I类分子形成的复合物。Tc细胞的协同受体CD8协助TCR与MHC分子的相互识别。
T细胞受体位于细胞膜外的末端有裂隙,结构多变,是可变区。如果TCR与MHC结构相匹配,能够形成如氢键、离子键等次级键,两者之间便进行特异性结合并接受MHC I上提呈的抗原肽,并激活Tc细胞,导致Tc细胞大量增殖。增殖后的Tc细胞释放穿孔素和颗粒酶。
穿孔素的作用是在受感染靶细胞膜上形成多聚穿孔素管状通道,导致受感染靶细胞溶解。颗粒酶是一组丝氨酸蛋白酶,迅速引起靶细胞DNA断裂,造成受感染靶细胞调亡。
2.抗原与抗体的特异性结合
免疫球蛋白(immunoglobulin,Ig)指具有抗体活性的蛋白质。主要存在于血浆中,也见于其他体液、组织和一些分泌液中。
抗体是机体免疫细胞被抗原激活后,由B细胞分化成熟为浆细胞后所合成、分泌的一类能与相应抗原特异性结合的具有免疫功能的球蛋白。在电泳时主要出现于γ球蛋白区域,占血浆蛋白质的20%;某些β-球蛋白和α2-球蛋白也含有免疫球蛋白。
Ig能识别、结合特异抗原,形成抗原-抗体复合物,激活补体系统从而解除抗原对机体的损伤。
(1)免疫球蛋白的结构特点
免疫球蛋白可分为 IgG、IgA、IgM、IgD、IgE,结构相类似,均由两条相同的重链(heavy chain,H链)和两条相同的轻链(light chain,L链)组成。其中IgG、D、E为四聚体,IgA为二聚体,IgM是五聚体(图1-19)。
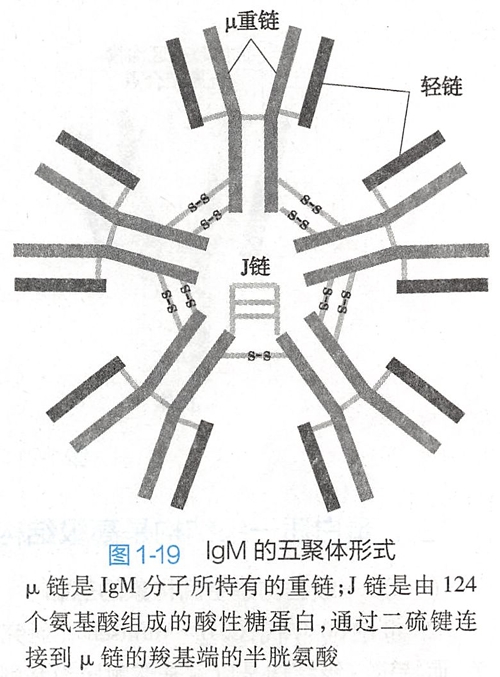
IgM的分子量在免疫球蛋白中最大,为 970kD,称为巨球蛋白(macroglobulin),图1-20显示IgG的分子结构。(应该是四聚体其中一个亚基)
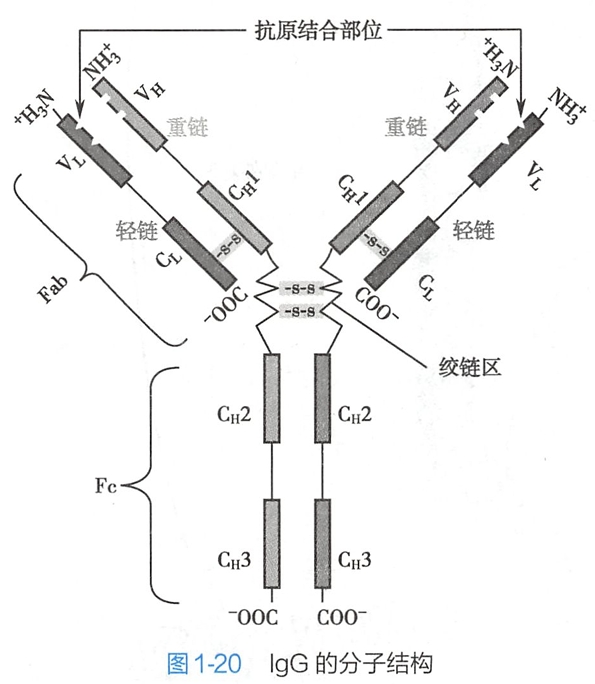
从N-端起,H链的1/4肽段及L链的1/2肽段在各类Ig的排列顺序可变性大,称可变区(variable region,V区),其功能是决定不同Ig与抗原结合的特异性。由L链和H链可变区形成的高变区是抗原结合的部位。
H及L链的其余肽段称为恒定区(constant region,C区)。C区的功能是决定Ig的效应作用,也是Ig的分类基础。
每条L链由可变区(VL)和恒定区(CL)组成。L链有两个基本型,即κ和λ型。一个特异的免疫球蛋白通常只含有两条κ链或两条λ链,不存在κ和λ的混合型。
每条H链也可由可变区(VH)和恒定区(CH)组成,其中恒定区分为三个结构域(CH1、CH2、CH3),CH2结构域含有补体结合部位。CH3结构域含有与中性粒细胞和巨噬细胞受体接触的部位。根据H链抗原性的差异可将其分为5类:μ链、γ链、α链、δ链和ε链,不同H链与L链(κ或λ链)组成完整免疫球蛋白的分子,分别称之为免疫球蛋白M、免疫球蛋白G、免疫球蛋白A、免疫球蛋白D和免疫球蛋白E。
L链和H链之间由二硫键连接,H链之间也由二硫键连接。
(2)抗原-抗体的特异性结合反应
由于抗原、抗体在结构上具有互相识别互相嵌合的构象,抗原分子的抗原决定簇(抗原表位)与抗体分子的超变区中沟槽分子表面的抗原结合点之间在化学结构和空间结构上是互补关系(图1-21),所以抗原抗体结合反应是特异性的。
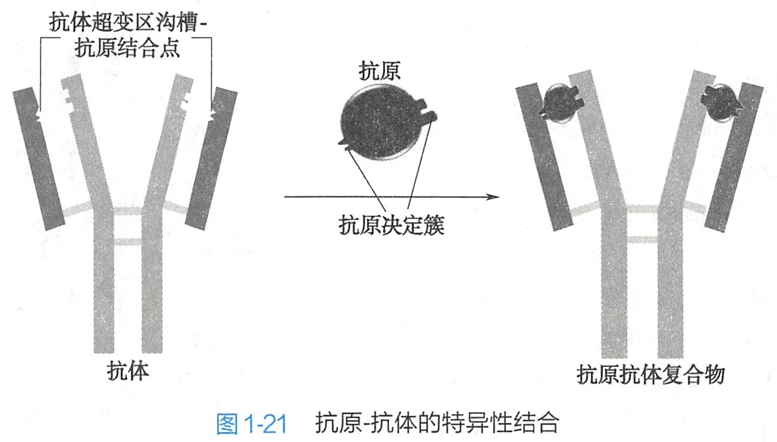
天然抗原表面常常带有多种抗原表位,每种表位均能刺激机体产生一种特异性抗体,即一个抗原分子会刺激机体产生多种特异性抗体。
三、蛋白质一级结构是高级结构与功能的基础
(一)一级结构是空间构象的基础
蛋白质的功能与其三级结构密切相关,而特定三级结构是以氨基酸顺序为基础的。空间构象遭破坏的核糖核酸酶A只要其一级结构(氨基酸序列)未被破坏,就有可能回复到原来的三级结构,功能依然存在。
(二)一级结构相似的蛋白质具有相似的高级结构与功能
蛋白质一级结构的比较,常被用来预测蛋白质之间结构与功能的相似性。同源性较高的蛋白质之间,可能具有相类似的功能。值得指出的是,同源蛋白质是指由同一基因进化而来的相关基因所表达的一类蛋白质。
在对不同物种中具有相同功能的蛋白质进行结构分析时,发现它们具有相似的氨基酸序列。
人类有 20%~30%的蛋白质具有多态性(polymorphism),即在人类群体中的不同个体间,这些蛋白质存在着氨基酸序列的多样性,但几乎不影响蛋白质的功能。
(三)氨基酸序列与生物进化信息
通过比较一些广泛存在于生物界不同种系间的蛋白质的一级结构,可以帮助了解物种进化间的关系。如细胞色素c(cytochrome c),物种间越接近,则一级结构越相似,其空间构象和功能也相似。
(四)重要蛋白质的氨基酸序列改变可引起疾病
从大量人类遗传性疾病的基因与相关蛋白质分析结果,获知这些疾病的病因可以是基因点突变引起1个氨基酸的改变,如镰状细胞贫血(sickle-cell anemia);也可以是基因大片段碱基缺失导致大片段肽链的缺失,如肌营养不良症(muscular dystrophy)。
例如,正常人血红蛋白β亚基的第6位氨基酸是谷氨酸,而镰状细胞贫血病人的血红蛋白中,谷氨酸变成了缬氨酸,即酸性氨基酸被中性氨基酸替代,仅此一个氨基酸之差,原是水溶性的血红蛋白,就聚集成丝,相互黏着,导致红细胞变形成为镰刀状而极易破碎,产生贫血。这种蛋白质分子发生变异所导致的疾病,被称之为“分子病(molecular disease)”,其病因为基因突变所致。
但并非一级结构中的每个氨基酸都很重要,如Cyt c,这个蛋白质分子中在某些位点即使置换数十个氨基酸残基,其功能依然不变。
四、蛋白质的功能依赖特定空间结构
体内蛋白质所具有的特定空间构象都与其发挥特殊的生理功能有着密切的关系。例如角蛋白含有大量α-螺旋结构,与富含角蛋白组织的坚韧性并富有弹性直接相关;而丝心蛋白分子中含有大量β-折叠结构,致使蚕丝具有伸展和柔软的特性。
(一)血红蛋白亚基与肌红蛋白结构相似
肌红蛋白(myoglobin,Mb)与血红蛋白都是含有血红素辅基的蛋白质。
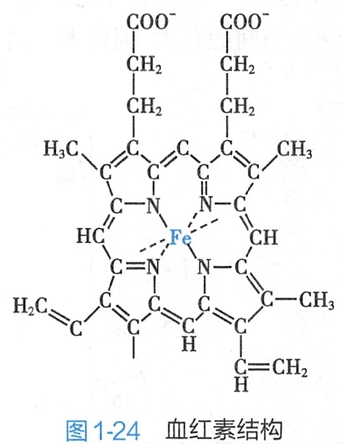
血红素是铁卟啉化合物(图1-24),它由4个吡咯环通过4个次甲基相连成为一个环形,Fe2+居于环中。Fe2+有6个配位键,其中4个与吡咯环的N配位结合,1个配位键和肌红蛋白的第93位(F8)组氨酸残基结合,氧则与Fe2+形成第6个配位键,接近第64位(E7)组氨酸。(这里N估计是sp2杂化)
从X射线衍射法分析获得的肌红蛋白的三维结构(见图1-13)中,可见它是一个只有三级结构的单链蛋白质,有8个α-螺旋结构肽段,分别用字母A~H命名。整条多肽链折叠成紧密球状分子,氨基酸残基上的疏水侧链大都在分子内部,富极性及电荷的侧链则在分子表面,因此其水溶性较好。
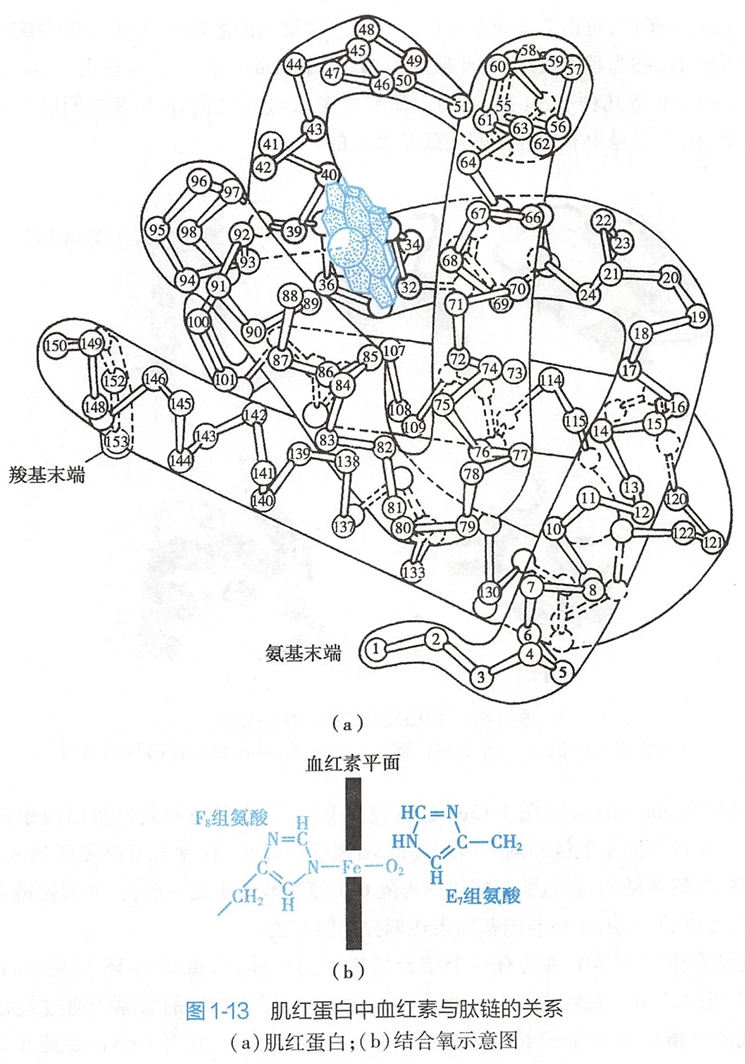
Mb分子内部有一个袋形空穴,血红素居于其中。血红素分子中的两个丙酸侧链以离子键形式与肽链中的两个碱性氨基酸侧链上的正电荷相连,加之肽链中的F8组氨酸残基还与Fe2+形成配位结合,所以血红素辅基可与蛋白质部分稳定结合。
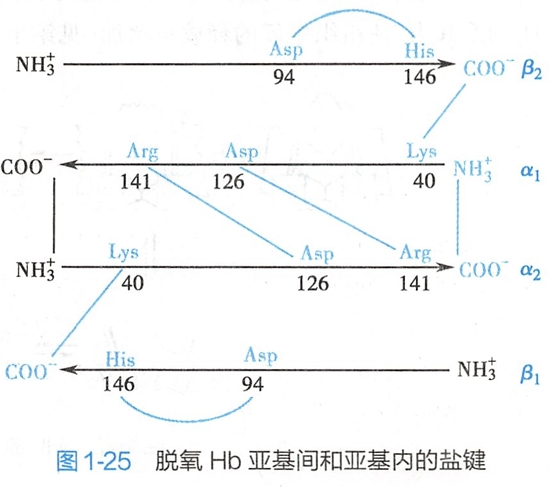
血红蛋白(hemoglobin,Hb)是由4个亚基组成的四级结构(见图1-17)蛋白质,每个亚基结构中间有一个疏水局部,可结合1个血红素并携带1分子氧,因此一分子Hb共结合4分子氧。成年人红细胞中的Hb主要由2条α肽链和2条β肽链(α2β2)组成。胎儿期的Hb主要为α2γ2,胚胎期为α2ε2。此外,在成人Hb中存在较少的α2δ2型,而镰状细胞贫血病人红细胞中的Hb为α2S2。Hb的β、γ和δ亚基的一级结构高度保守。Hb各亚基的三级结构与Mb极为相似。Hb亚基之间通过8对盐键(图1-25),使4个亚基紧密结合而形成亲水的球状蛋白质。
(二)血红蛋白亚基构象变化可影响亚基与氧结合
Hb与Mb一样可逆地与O2结合,氧合Hb占总Hb的百分数(称百分饱和度)随O2浓度变化而变化。图1-26为Hb和Mb的氧解离曲线,前者为S状曲线,后者为直角双曲线。可见,Mb易与O2结合,而Hb与O2的结合在O2分压较低时较难。
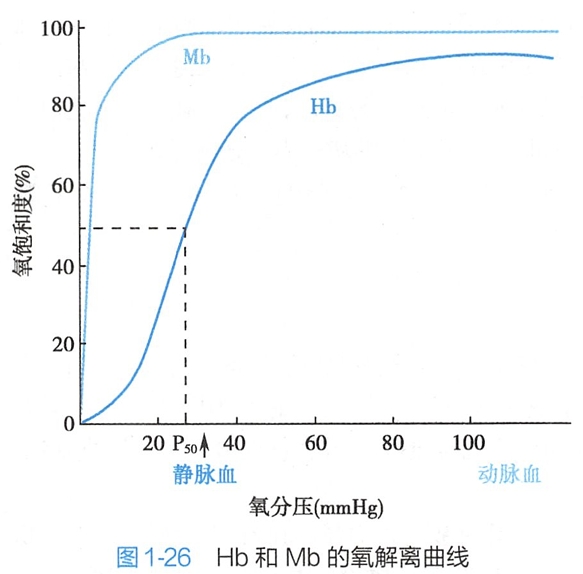
Hb与O2结合的“S”形曲线提示Hb的4个亚基与4个O2结合时有4个不同的平衡常数。Hb最后一个亚基与O2结合时其常数最大,从“S”形曲线的后半部呈直线上升可证明此,点。根据“S”形曲线的特征可知,Hb中第一个亚基与O2结合以后,促进第二及第三个亚基与O2的结合,当前3个亚基与O2结合后,又大大促进第四个亚基与O2结合,这种效应称为正协同效应(positive cooperativity)。
协同效应的定义是指一个亚基与其配体(Hb中的配体为O2)结合后,能影响此寡聚体中另一亚基与配体的结合能力。如果是促进作用则称为正协同效应;反之则为负协同效应。
未结合O2时,Hb的α1/β1和α2/β2呈对角排列,结构较为紧密,称为紧张态(tense state,T态),T态Hb与O2的亲和力小。随着O2的结合,4个亚基的羧基末端之间的盐键断裂,其二级、三级和四级结构也发生变化,使α1/β1和α2/β2的长轴形成15°的夹角(图1-27),结构显得相对松弛,称为松弛态(relaxed state,R态)。
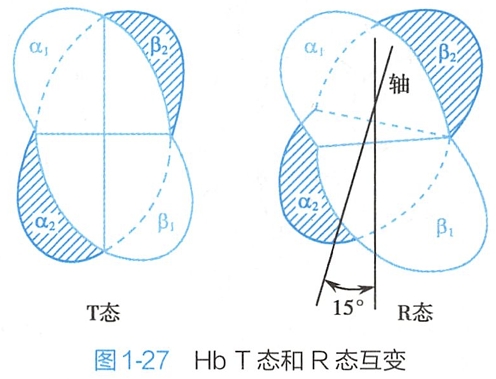
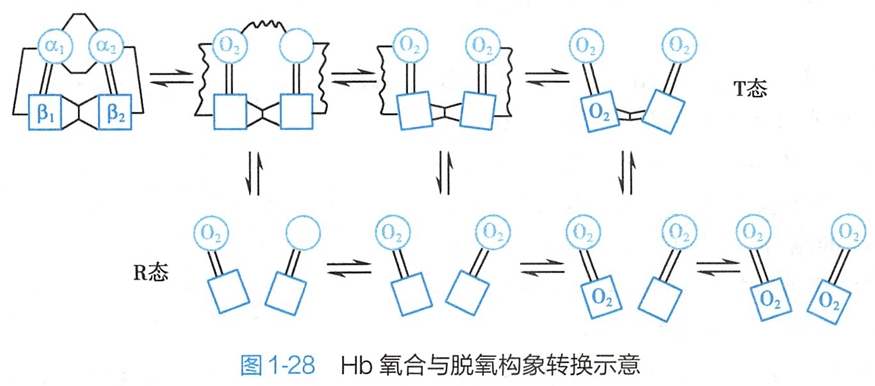
图1-28显示了Hb氧合与脱氧时T态和R态相互转换的可能方式。T态转变成R态是逐个结合O2而完成的。
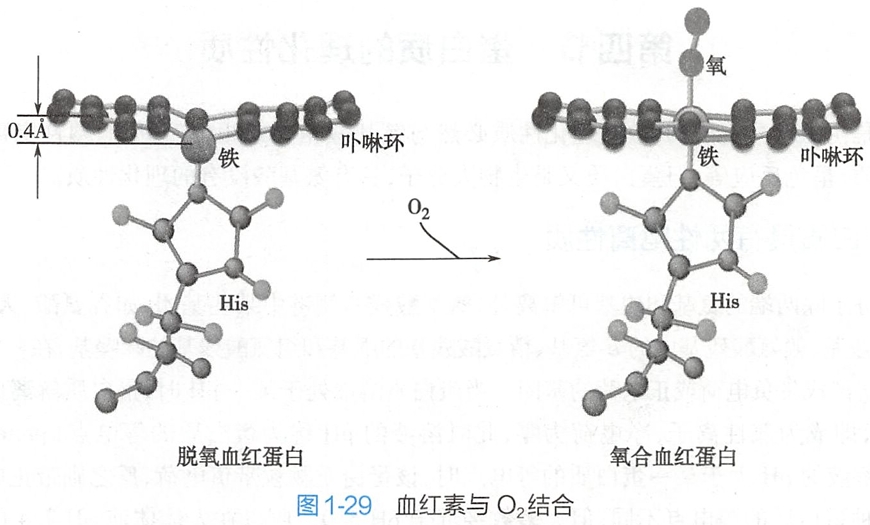
在脱氧Hb中,Fe2+半径比卟啉环中间的孔大,因此Fe2+高出卟啉环平面0.04nm(0.4A),而靠近F8位组氨酸残基。当第1个O2与血红素Fe2+结合后,使Fe2+的半径变小,进入到卟啉环中间的小孔中(图1-29),引起F肽段等一系列微小的移动,同时影响附近肽段的构象,造成两个α亚基间盐键断裂,使亚基间结合松弛,可促进第二个亚基与O2结合,依此方式可影响第三、四个亚基与O2结合,最后使4个亚基全处于R态。
此种一个氧分子与Hb亚基结合后引起其他亚基构象变化,称为别构效应(allosteric effect)。小分子O2称为别构剂或效应剂,Hb则被称为别构蛋白。
别构效应不仅发生在Hb与O2之间,一些酶与别构剂的结合,配体与受体结合也存在着别构效应,所以它具有普遍生物学意义。
为了适应高海拔氧气稀薄的状态,人体内可通过多种调控,如增加红细胞数量、Hb浓度和2,3-二磷酸甘油酸(2,3-BPG)浓度等,提供充足的氧,以保障正常新陈代谢。升高的2,3-BPG可降低Hb与O2的亲和力,使组织中氧的释放量增加(见第十八章)。
(三)蛋白质构象改变可引起疾病
若蛋白质的折叠发生错误,尽管其一级结构不变,但蛋白质的构象发生改变,仍可影响其功能,严重时可导致疾病发生,有人将此类疾病称为蛋白质构象疾病。
有些蛋白质错误折叠后相互聚集,常形成抗蛋白水解酶的淀粉样纤维沉淀,产生毒性而致病,这类疾病包括人纹状体脊髓变性病、阿尔茨海默病(Alzheimer disease)、亨廷顿病(Huntington disease)、疯牛病等。
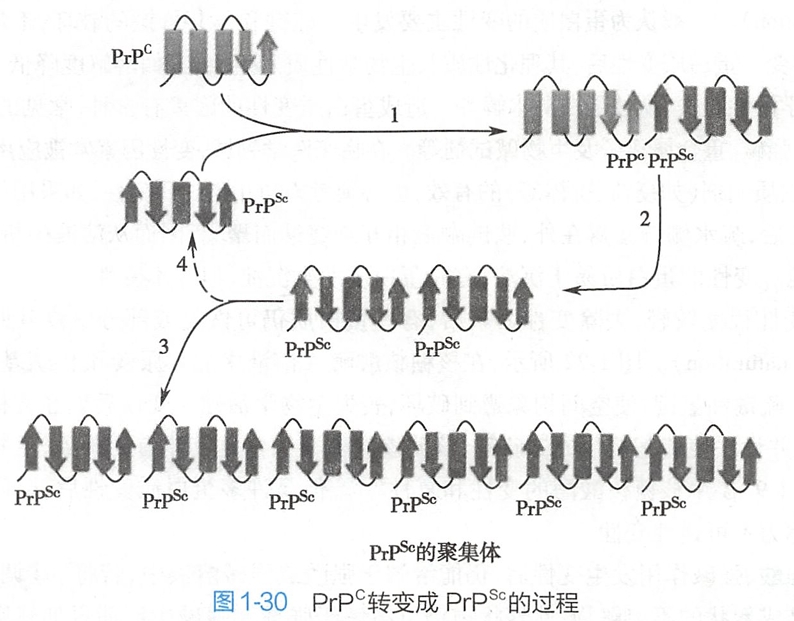
疯牛病是由朊病毒蛋白(prion protein,PrP)引起的一组人和动物神经退行性病变,这类疾病具有传染性、遗传性或散在发病的特点,其在动物间的传播是由PrP组成的传染性蛋白质颗粒(不含核酸)完成的。
PrP是染色体基因编码的蛋白质。正常动物和人PrP为分子量33~35kD的蛋白质,其水溶性强、对蛋白酶敏感,二级结构为多个α-螺旋,称为PrPC。富含α-螺旋的PrPC在某种未知蛋白质的作用下可转变成分子中大多数为β-折叠的PrP,称为PrPSc。但PrPC和PrPSc两者的一级结构完全相同。
外源或新生的PrPSc可以作为模板,通过复杂的机制诱导含α-螺旋的PrPC重新折叠成为富含β-折叠的PrPSc,并可形成聚合体(图1-30)。PrPSc对蛋白酶不敏感,水溶性差,而且对热稳定,可以相互聚集,最终形成淀粉样纤维沉淀而致病。