氨基酸和肽
蛋白质元素组成相似,主要有碳(50%~55%)、氢(6%~7%)、氧(19%~24%)、氮(13%~19%)和硫(0~4%)。有些蛋白质还含有少量磷或金属元素铁、铜、锌、锰、钴、钼等,个别蛋白质还含有碘。
各种蛋白质的含氮量很接近,平均为16%。由于蛋白质是体内的主要含氮物质,因此测定生物样品的含氮量就可按下式推算出蛋白质大致含量:
每克样品含氮克数×6.25×100=100g样品中蛋白质含量(g%)
一、L-α-氨基酸
人体内蛋白质是以20种氨基酸(amino acid)为原料合成的多聚体,因此氨基酸是组成蛋白质的基本单位。
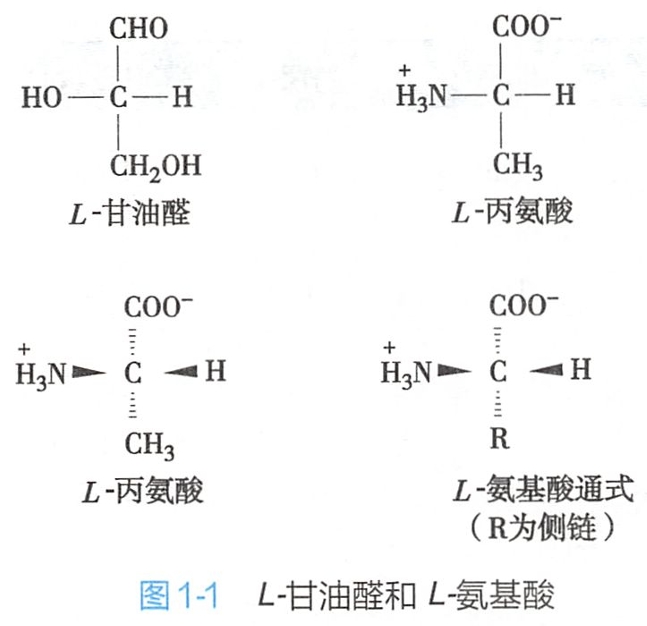
由图1-1可见,连在-COO-基上的碳称为α-碳原子,为不对称碳原子(甘氨酸除外)。
300余种自然界中的氨基酸:
- 蛋白质氨基酸:
- 人体:
- 甘氨酸、19种L-α-氨基酸
- 硒代半胱氨酸(这个应该也是L-α-氨基酸吧):硒代半胱氨酸从结构上来看,硒原子替代了半胱氨酸分子中的硫原子。硒代半胱氨酸存在于少数天然蛋白质中,包括过氧化物酶和电子传递链中的还原酶等。硒代半胱氨酸参与蛋白质合成时,并不是由目前已知的密码子编码,具体机制尚不完全清楚。
- 其他:
- 吡咯赖氨酸:产甲烷菌的甲胺甲基转移酶中
- D型氨基酸:微生物膜内的D-谷氨酸、个别抗生素中(例如短杆菌肽含有D-苯丙氨酸)及低等生物体内(例如蚯蚓D-丝氨酸)
- 人体:
- 非蛋白质氨基酸:如一些L-α-氨基酸,参与合成尿素的鸟氨酸(ornithine)、瓜氨酸(citrulline)和精氨酸代琥珀酸(argininosuccinate)。
二、氨基酸分类
20种氨基酸根据其侧链的结构和理化性质可分成5类:①非极性脂肪族氨基酸;②极性中性氨基酸;③芳香族氨基酸;④酸性氨基酸;⑤碱性氨基酸(表1-1)。(不推荐这种分类方式,有机化学和细生的分类不比这个好?酪氨酸和色氨酸也是极性中性氨基酸吧?)
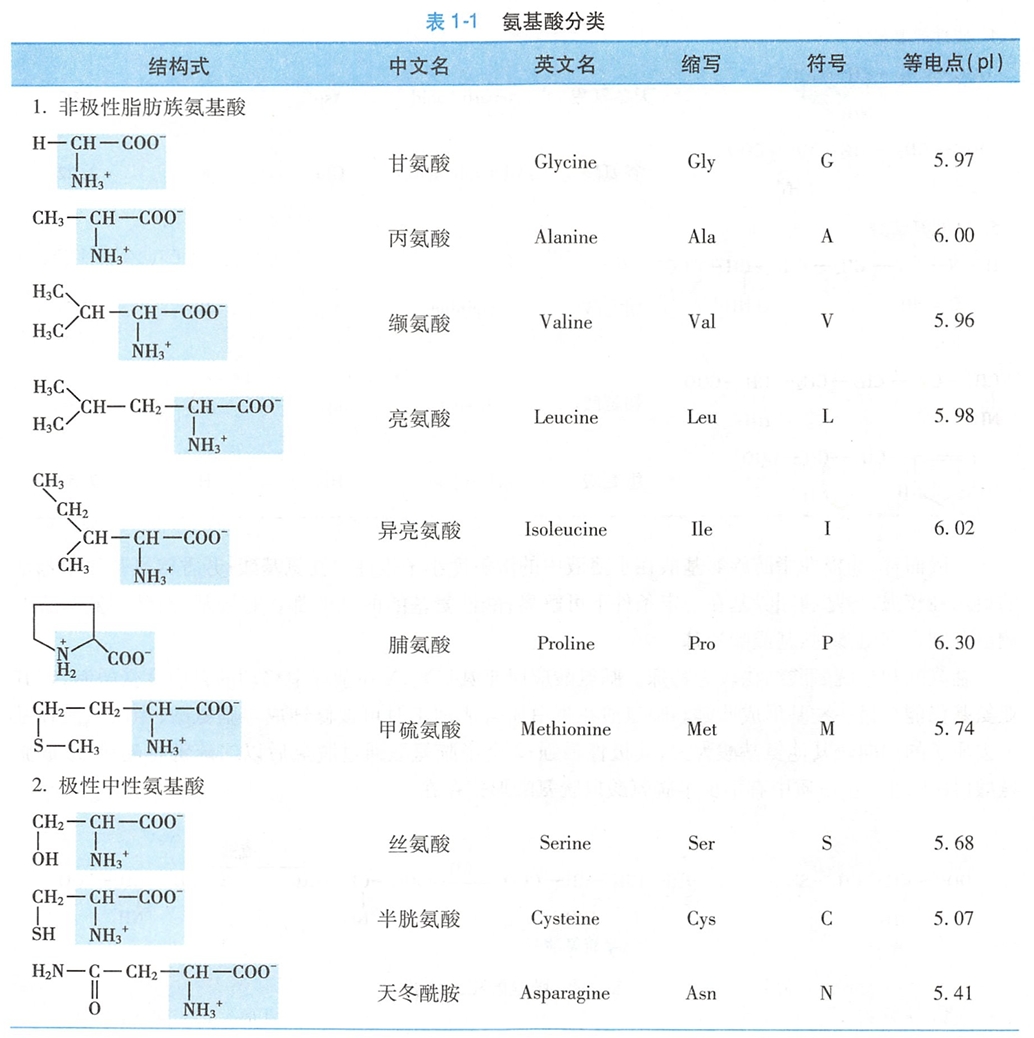
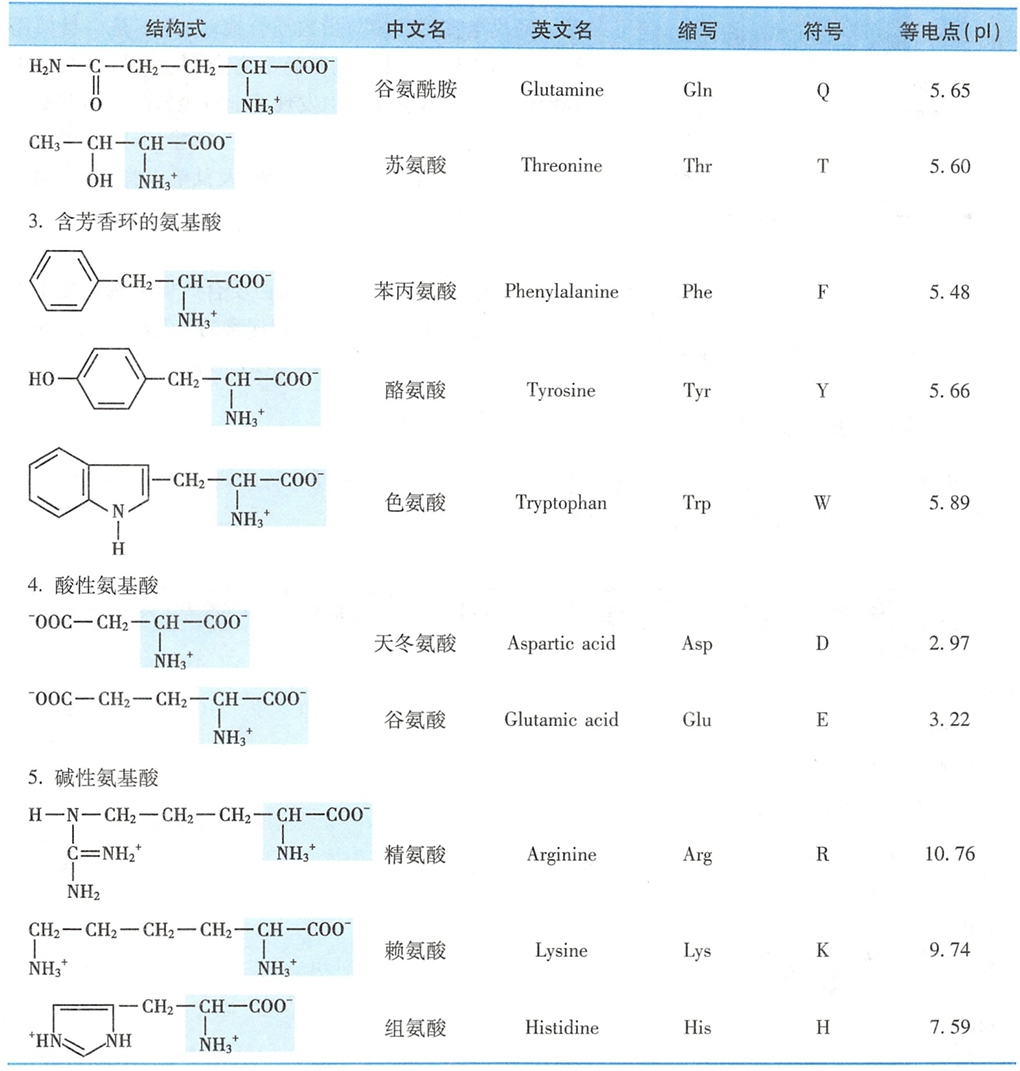
一般而言,非极性脂肪族氨基酸在水溶液中的溶解度小于极性中性氨基酸;芳香族氨基酸中苯基的疏水性较强,酚基和吲哚基在一定条件下可解离;
酸性氨基酸的侧链都含有羧基;而碱性氨基酸的侧链分别含有氨基、胍基或咪唑基。
脯氨酸和半胱氨酸结构较为特殊。脯氨酸应属亚氨基酸,N在杂环中移动的自由度受限制,但其亚氨基仍能与另一羧基形成肽键。脯氨酸在蛋白质合成加工时可被修饰成羟脯氨酸(可被磷酸化修饰);
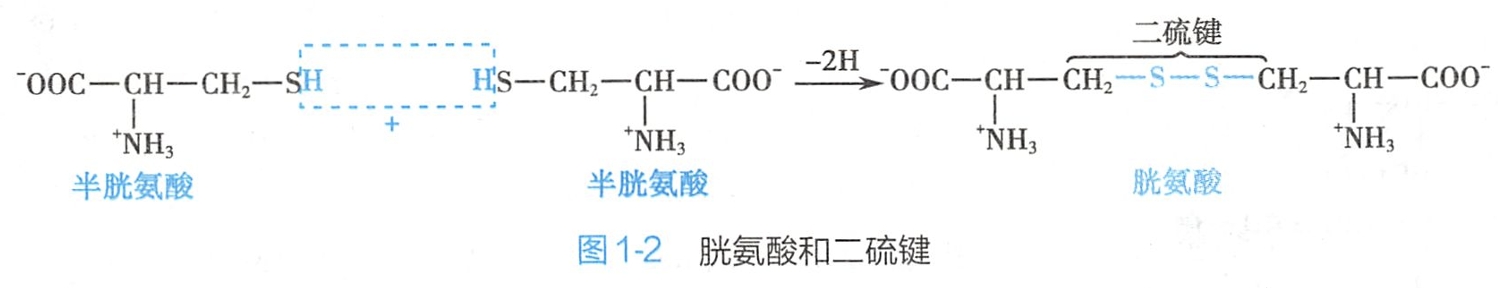
半胱氨酸巯基失去质子的倾向较其他氨基酸为大,其极性最强;2个半胱氨酸通过脱氢后以二硫键相连接,形成胱氨酸(图1-2)。蛋白质中有不少半胱氨酸以胱氨酸形式存在。
在蛋白质翻译后的修饰过程中,脯氨酸和赖氨酸可分别被羟化为羟脯氨酸和羟赖氨酸。蛋白质分子中20种氨基酸残基的某些基团还可被甲基化、甲酰化、乙酰化、异戊二烯化和磷酸化等。这些翻译后修饰,可改变蛋白质的溶解度、稳定性、亚细胞定位和与其他细胞蛋白质相互作用的性质等,体现了蛋白质生物多样性的一个方面。
三、氨基酸的理化性质
(一)氨基酸具有两性解离的性质
氨基酸是一种两性电解质,具有两性解离的特性。氨基酸的解离方式取决于其所处溶液的酸碱度。在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的pH称为该氨基酸的等电点(amino acid isoelectric point,pI)。通常氨基酸的pI是由α-羧基和α-氨基的解离常数的负对数pK1和pK2决定的。pl计算公式为:pl=(pK1+ pK2)/2。若一个氨基酸有3个可解离基团,写出它们电离式后取兼性离子两边的pK的平均值,即为此氨基酸的pI。
(二)含共轭双键的氨基酸具有紫外线吸收性质
根据氨基酸的吸收光谱,含有共轭双键的色氨酸、酪氨酸的最大吸收峰在280nm波长附近。由于大多数蛋白质含有酪氨酸和色氨酸残基,所以测定蛋白质溶液280nm的光吸收值,是分析溶液中蛋白质含量的快速简便的方法。 #有机
(三)氨基酸与茚三酮反应生成蓝紫色化合物
茚三酮反应(ninhydrin reaction)指的是茚三酮水合物在弱酸性溶液中与氨基酸共加热时,氨基酸被氧化脱氨、脱羧,而茚三酮水合物被还原,其还原物可与氨基酸加热分解产生的氨结合,再与另一分子茚三酮缩合成为蓝紫色的化合物,此化合物最大吸收峰在570nm波长处。由于此吸收峰值的大小与氨基酸释放出的氨量成正比,因此可作为氨基酸定量分析方法。
四、氨基酸通过肽键连接
连接两个氨基酸的酰胺键称为肽键(peptide bod)。一般而言,由2~20个氨基酸相连而成的肽称为寡肽(oligopeptide),而更多的氨基酸相连而成的肽称为多肽(polypeptide)。。肽链中的氨基酸分子因脱水缩合而基团不全,被称为氨基酸残基(amino acid residue)。
一般而论,蛋白质的氨基酸残基数通常在50个以上,50个氨基酸残基以下则仍称为多肽。例如,常把由 39个氨基酸残基组成的促肾上腺皮质激素称作为多肽,而把含有51个氨基酸残基、分子量为5733的胰岛素称作蛋白质。
五、生物活性肽
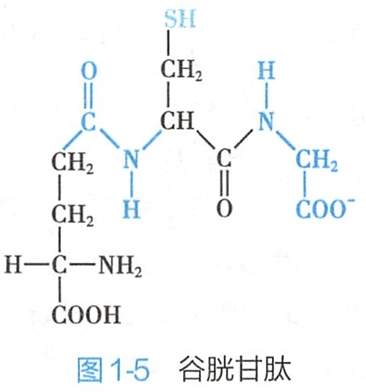
(一)谷胱甘肽
谷胱甘肽(glutathione,GSH)是由谷氨酸、半胱氨酸和甘氨酸组成的三肽。
第一个肽键是非α肽键,由谷氨酸γ羧基与半胱氨酸的氨基组成(图1-5),分子中半胱氨酸的巯基是该化合物的主要功能基团。
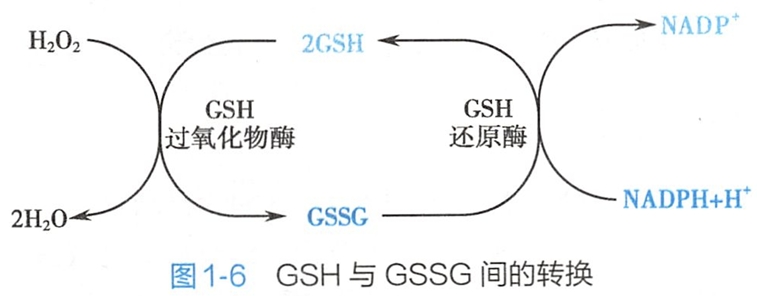
GSH的疏基具有还原性,可作为体内重要的还原剂保护体内蛋白质或酶分子中巯基免遭氧化,使蛋白质或酶处在活性状态。在谷胱甘肽过氧化物酶的催化下,GSH可还原细胞内产生的 H202,使其变成H20,与此同时,GSH被氧化成氧化型谷胱甘肽(GSSG)(图1-6),后者在谷胱甘肽还原酶催化下,再生成GSH。
此外,GSH的巯基还有嗜核特性,能与外源的嗜电子毒物如致癌剂或药物等结合,从而阻断这些化合物与DNA、RNA或蛋白质结合,以保护机体免遭毒物损害。
(二)多肽类激素
体内有许多激素属寡肽或多肽,例如属于下丘脑-垂体-肾上腺皮质轴的催产素(9肽)、加压素(9肽)、促肾上腺皮质激素(39肽)、促甲状腺素释放激素(3肽)等。
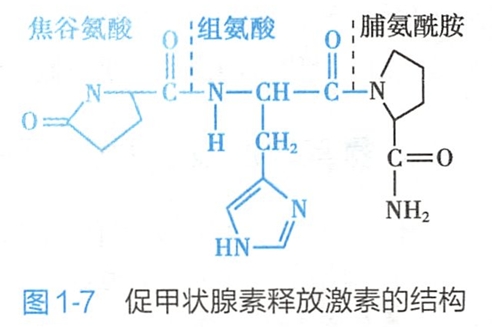
促甲状腺素释放激素是一个特殊结构的三肽(图1-7),其N-端的谷氨酸环化成为焦谷氨酸(pyroglutamic acid),C-端的脯氨酸残基酰化成为脯氨酰胺,它由下丘脑分泌,可促进腺垂体分泌促甲状腺素。
(三)神经肽
有一类在神经传导过程中起信号转导作用的肽类被称为神经肽(neuropeptide)。较早发现的有脑啡肽(5肽)、β-内啡肽(31肽)和强啡肽(17肽)等。近年还发现孤啡肽(17肽),其一级结构类似于强啡肽。它们与中枢神经系统产生痛觉抑制有密切关系。因此很早就被用于临床的镇痛治疗。除此以外,神经肽还包括P物质(10肽)、神经肽Y等。