烷烃
由碳和氢两种元素组成的化合物称为烃(hydrocarbon),其中烷烃的通式为CnH2n+2。其他各类有机化合物可视为烃的衍生物(derivatives),如甲醇CH3OH可视为CH4分子中的一个H原子被轻基-OH取代的衍生物。
一、结构
烷烃(alkane)分子的所有碳原子均为sp3杂化,原子之间以单键(σ键)相连。
甲烷是最简单的烷烃分子,其碳原子的4个sp3杂化轨道分别与4个氢原子的s轨道沿键轴方向重叠,形成4个C-Hσ键,分子中的键角均为109°28',在空间呈正四面体排布。
烷烃的碳原子均为饱和碳原子,按照与它直接连接的碳原子的数目不同,可分为伯、仲、叔、季碳原子,又称为一、二、三、四级碳原子,分别用1°、2°、3°和4°表示。
二、构造异构和命名
分子式相同的不同化合物彼此互为同分异构体,简称异构体(isomer)。分子中原子间相互连接的次序和方式称为构造。构造异构是指分子式相同,分子中原子间相互连接的次序和方式不同而形成不同化合物的现象。
(一)碳链异构
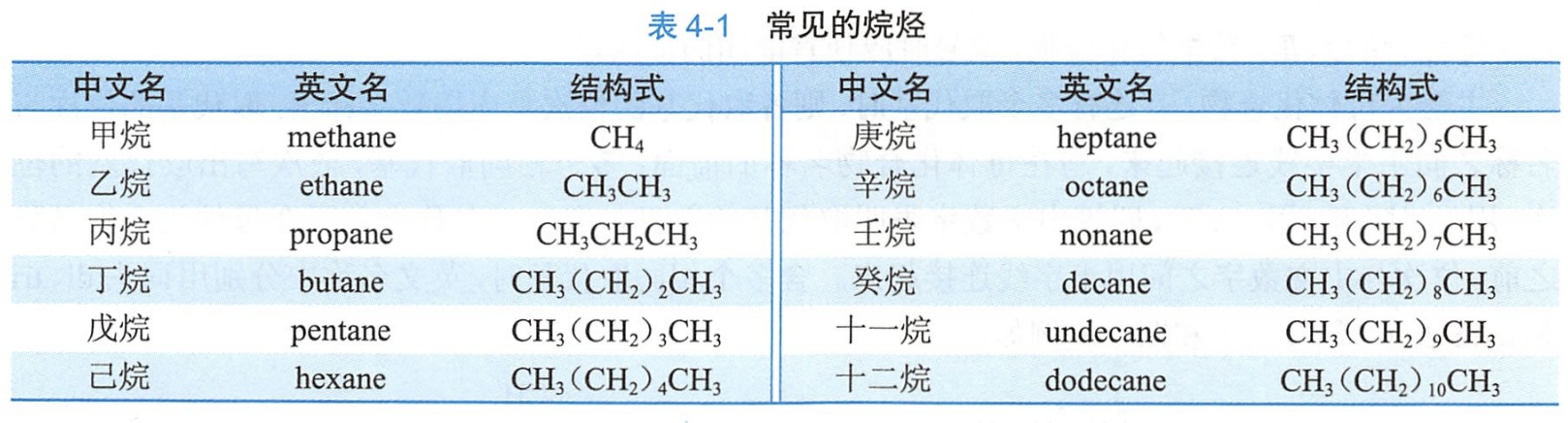
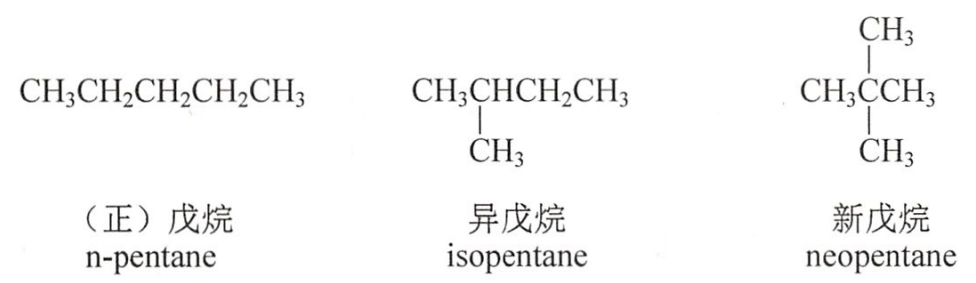
甲烷、乙烷和丙烷分子只存在一种碳原子连接方式,无异构体。随着碳原子数的增加,烷烃可以有多种碳原子连接方式。
具有相同的分子式,由于碳链结构不同而产生的同分异构现象称为碳链异构。碳链异构属于构造异构。
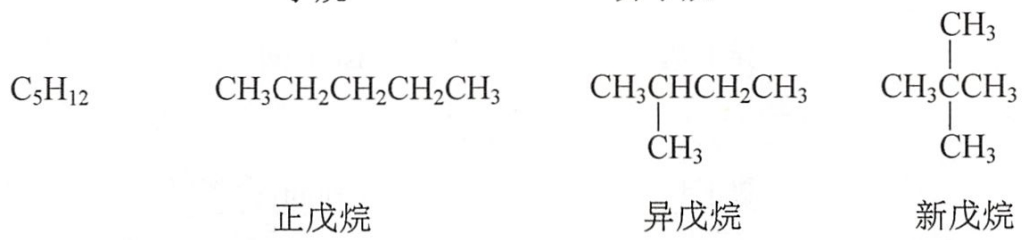
(二)命名
烷烃的命名原则是各类有机化合物命名的基础。烷烃的命名通常分为普通命名法(common nomenclature)和系统命名法(systematic nomenclature)。
1.普通命名法
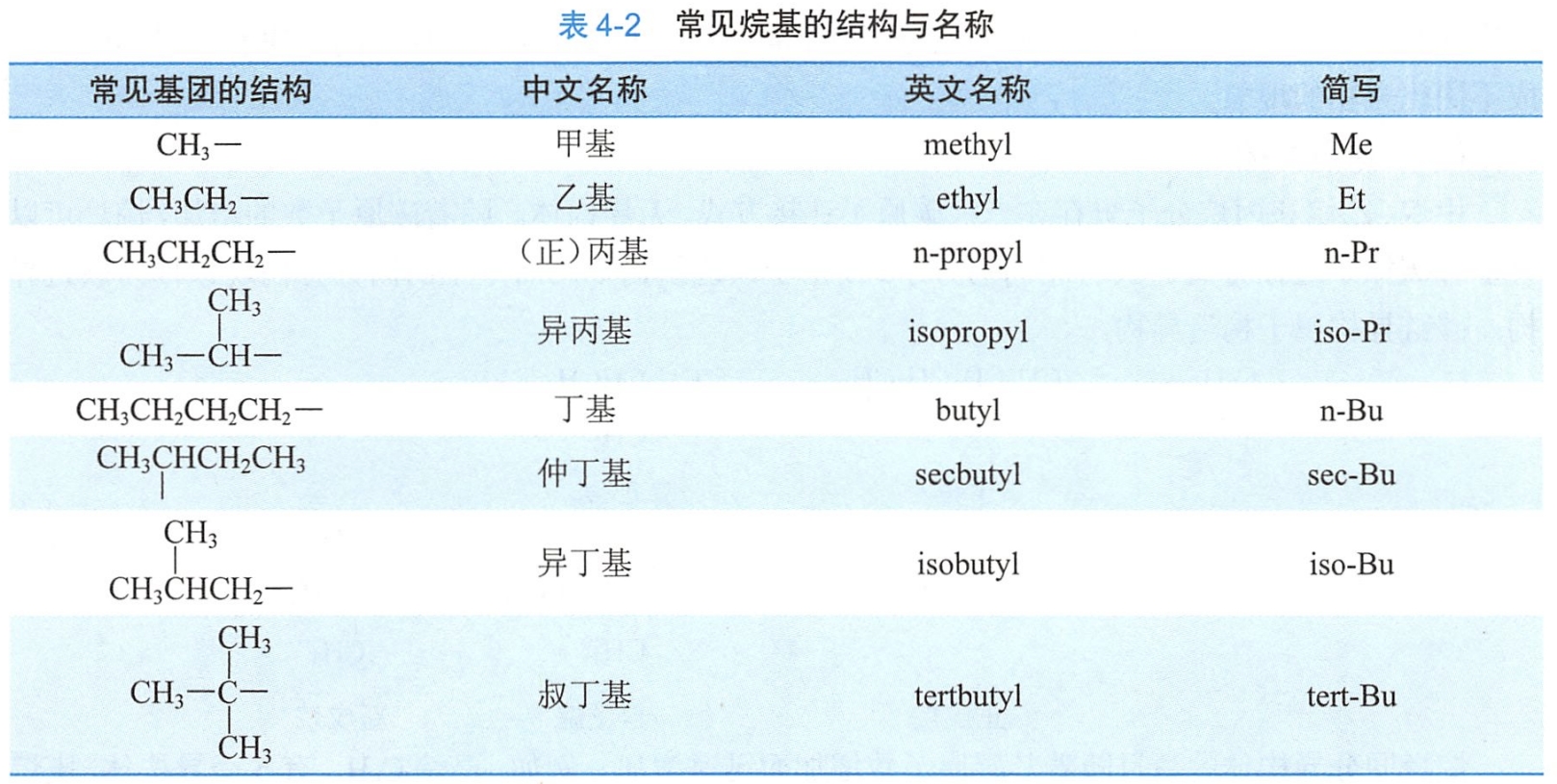
烃分子中去掉一个氢原子,所剩下的基团叫做烃基,用R-表示。命名烷基时,把相应的烷烃命名中的“烷”字改为“基”字。烷基的英文命名只需将烷烃词尾的-ane改为-yl,常见的烷基结构和名称见表4-2。
2.系统命名法
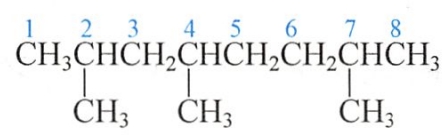
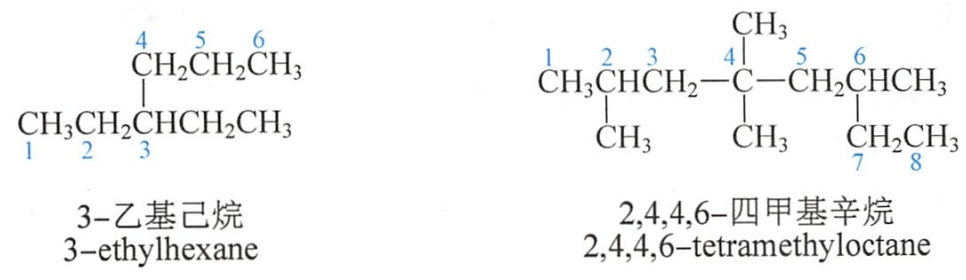
主链上若连有不同的取代基(非官能团),应按以下的次序规则比较次序,要注意优先的取代基是后列出的。常见烷基的优先顺序是:
异丙基>异丁基>丁基>丙基>乙基>甲基
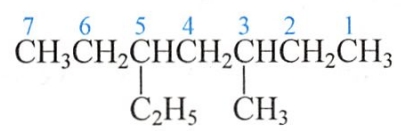
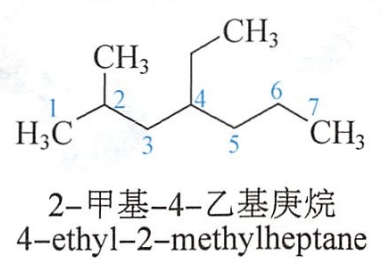
在英文命名中,取代基是按字首的字母排列顺序先后列出。
三、构象异构
由于碳碳单键可自由旋转,导致分子中原子或原子团在空间的不同排列方式称为构象(conformation)。由此产生的异构体称为构象异构体(conformational isomer)。构象异构体的分子构造相同,但其空间排列取向不同,因此构象异构是立体异构中的一种。
(一)乙烷的构象
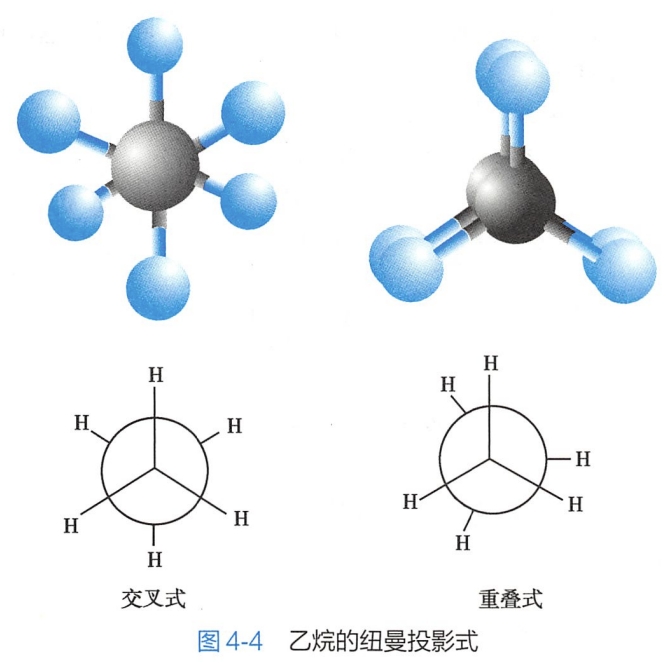
乙烷是最简单的含有C-C单键的化合物,如果固定乙烷分子中的一个碳原子,另一个碳原子围绕C-Cσ键旋转时,则该碳原子上的三个氢原子相对另一个碳原子上的三个氢,可以有无数种空间排列,即有无数种构象异构体,其中重叠式(eclipsed)和交叉式(staggered)是两种典型的构象。
常用锯架式(sawhorse formula)和纽曼投影式(Newman projection formula)表示烷烃的构象。
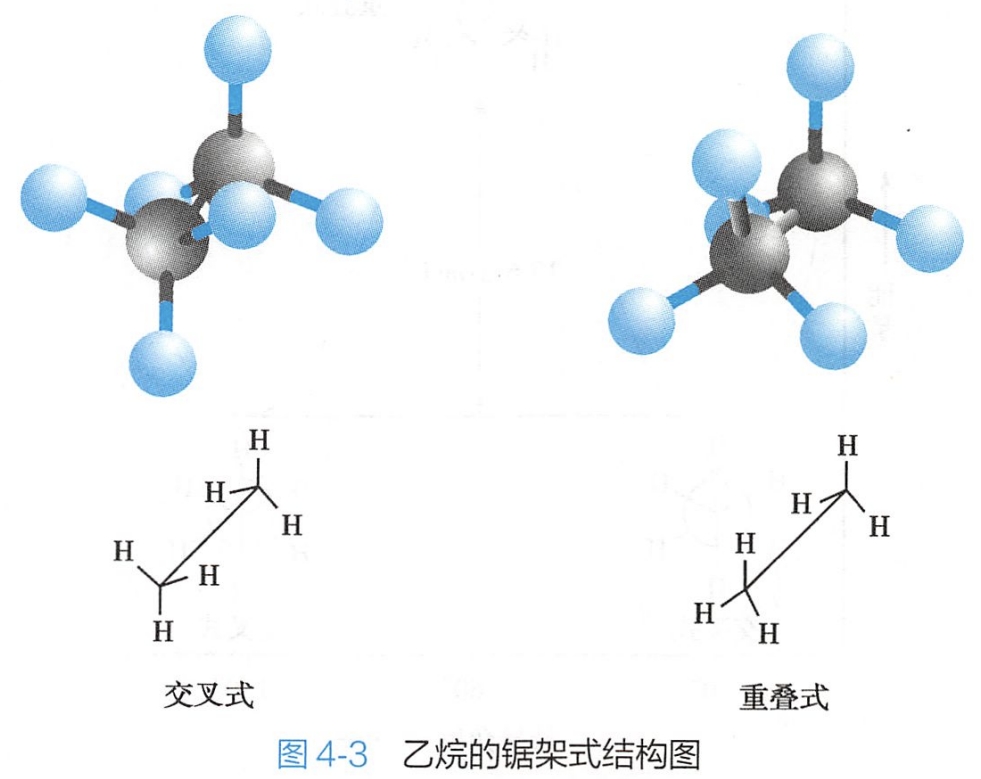
锯架式是从分子模型的侧面观察分子立体结构的表达方式,能直接反映碳原子和氢原子在空间的排列情况。图4-3为乙烷的锯架式结构图。
纽曼投影式是沿着C一C键轴观察分子模型所得的平面的表达方式,用圆圈表示碳原子,从圆圈中心伸出的三条直线,表示离观察者近的碳原子上的价键,而从圆周向外伸出的三条短线,表示离观察者远的碳原子上的价键(图4-4)。
在化合物分子中非键合的原子之间存在着相互作用力,其作用力的大小与原子间的距离有关,当该距离等于或大于它们的范德华(van der Waals)半径之和时,就相互吸引;当该距离小于范德华半径之和,它们就彼此排斥,从而产生范德华张力,又称为空间张力。
补充:范德华相互作用指的是没有化学键直接相连的粒子之间的相互作用。考虑一个极端情况,如果是十来个碳的一条长链烷烃,其首尾之间没有化学键直接相连,中间隔了多个CH2。这时候这两端的两个甲基之间就会存在范德华相互吸引(但很微弱,范德华相互作用依距离的负六次方衰减)。表现为长链烷烃不会是真的舒展的一条长链,而是会类似耳机线一样弯曲。长链烷烃两端因此有靠近的趋势。当然这个弯曲也有一大部分来自于熵的贡献。细致来看,只要两个原子之间相隔三个或者三个以上化学键,就会由范德华相互作用感受到彼此的存在。表现为分子内的二面角不一定都能自由旋转。分子内的范德华相互作用非常微弱,但由于范德华相互作用随着粒子数目的增多而增大,生物大分子内部具有相当大的范德华相互作用。
当乙烷分子处于交叉式构象时,两个碳原子上的氢原子之间相距最远,相互间斥力最小,分子的能量最低;随着分子中C-C键相对旋转,碳上氢原子之间的距离越来越近,相互之间的斥力逐渐增大,分子的内能逐渐升高,当碳原子上的氢原子距离最近时,分子的内能达到最高,此时乙烷分子处于重叠式:随着C-C键的继续相对旋转,碳上氢原子之间的距离越来越远,相互之间的斥力逐渐增减小,分子的内能逐渐降低,最终乙烷分子的构象又回复到交叉式。
乙烷分子的各种构象中,能量最低的构象是最稳定构象,也称为优势构象。交叉式构象的能量最低,所以交叉式是乙烷稳定的优势构象。乙烷的交叉式构象比重叠式构象低12.6kJ·mol-1,分子间的这一能垒并不难以逾越,因为室温下分子间的碰撞即可产生83.8kJ·mol-1的能量,足以使C-C键“自由”旋转,致使各构象间迅速互变,因此乙烷分子体系成为无数个构象异构体的动态平衡混合物,无法分离出其中某一构象异构体,但大多数乙烷分子是以最稳定的交叉式构象状态存在。介于交叉式和重叠式两种构象之间,尚有无数种构象,其能量也介于两者之间。