组织干细胞
组织干细胞是在成体组织内具有自我更新能力及能分化产生一种或一种以上特化细胞的原始细胞。在活体内,组织干细胞存在于特定的[200 学习/201 细胞生物学/第11章 细胞微环境/第1节 细胞微环境/细胞微环境|细胞微环境]中,具有直接参与其组织器官结构和功能动态平衡的维持的功能。所以,对于组织干细胞生物学特性的认识,不仅需要研究干细胞本身,而且更需要研究干细胞与其微环境之间的关系。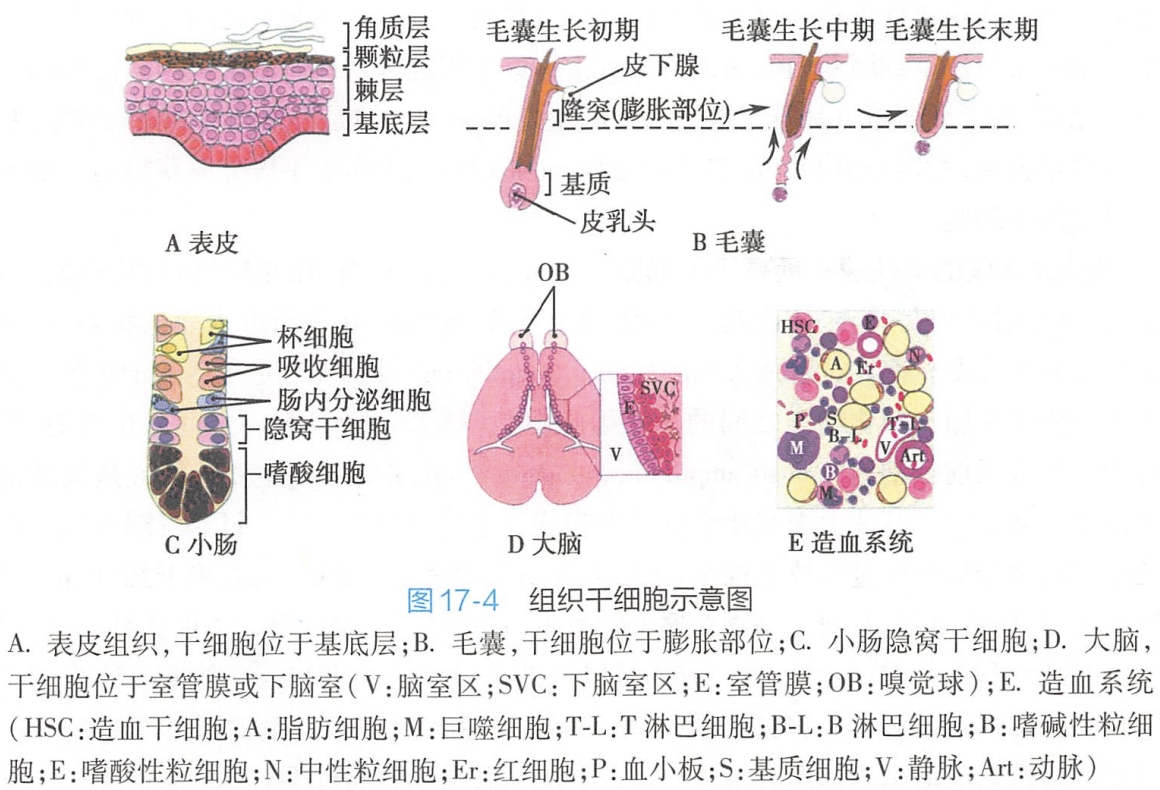
一、组织干细胞的基本特征
(一)组织干细胞的增殖相对缓慢而且具有自稳定性
1.干细胞的增殖速率相对较缓慢
生理状态下成体组织中干细胞的分裂比较慢,例如小鼠的造血干细胞每2.5周才复制一次,人的造血干细胞每10个月才复制一次。
干细胞的这种缓慢增殖对维持组织稳态具有重要意义。一方面有利于干细胞对特定的外界信号作出反应,以决定其细胞是进入增殖状态,还是进入特定的分化程序,另一方面还可以减少DNA复制过程中基因发生突变的概率,降低突变的累积。
2.干细胞增殖系统具有自稳定性
自稳定性(self-maintenance)是指干细胞可以在生物个体生命期间内自我更新(self-renewing)并维持其自身数目恒定的特性,它是干细胞的基本特征之一。
干细胞要维持自我更新,干细胞必须要进入细胞周期进行分裂,而且后代细胞必须至少有一个细胞能保持未分化状态,这两个方面如果不能保持相对平衡就会导致细胞缺损或者组织异常。研究表明,这种平衡的实现,即干细胞自我更新的维持,是通过干细胞不对称分裂来实现的。当干细胞发生分裂后,如果所产生的两个子代细胞都是干细胞或都是分化细胞,这种分裂方式称为对称分裂(symmetry division);如果产生一个干细胞和一个分化细胞,则称之为不对称分裂(asymmetry division)(图17-5)。
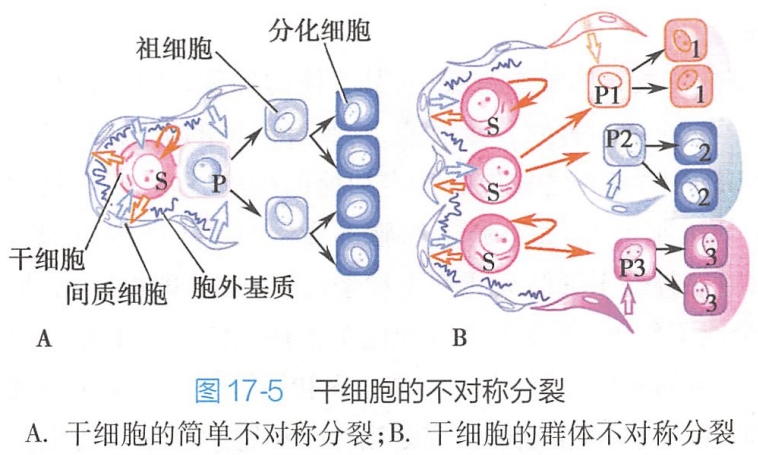
对无脊椎动物而言,不对称分裂是干细胞维持自身数目恒定的基本方式。例如,在果蝇的外周神经组织中,其感觉器官的前体细胞的不对称分裂是受一系列基因调控的,insc基因就是其中的一个。该基因的表达产物(即Insc蛋白)至少在三个方面对不对称分裂进行调控:
- 不对称地分配细胞膜上的膜联细胞命运因子(mem brane-associated cell fate determinant ) ,如Numb;
- 不对称地分配细胞内mRNA;
- 决定细胞分裂时纺锤体的取向。
但对哺乳动物而言,却并非如此简单。除了存在与上诉类似的单个细胞的不对称分裂外,在有些哺乳动物的可自我更新的组织中,干细胞产生的两个子细胞既可能是两个干细胞,也可能是两个特定分化细胞,即所谓的对称分裂。但平均而言,每一个干细胞可以产生一个子代干细胞和一个特定分化细胞。因此,从某种意义上讲,哺乳动物的干细胞是种群不对称分裂(populational asymmetry division)。
干细胞不对称分裂机制的存在,使得机体对干细胞的调控更具灵活性,可以更灵活的应对机体生理变化的需要。为了保持干细胞数目的恒定,机体需要对干细胞的分裂进行十分精密的调控。有研究表明,在小肠隐窝(cyt)中,如果额外多产生一个干细胞,则该干细胞进而就会多产生64~128个子代细胞,而每个正常隐窝仅由大约250个细胞组成。由此可见,维持干细胞数目的恒定有保持组织的稳定和功能的重要性。
不对称分裂是维持干细胞数量和干细胞特性的重要条件,但分裂后干细胞静息状态的维持和激活的调控更是在组织维持、再生、功能发挥、可塑性以及组织衰老和死亡中起决定作用的因素。
目前研究试图解释干细胞维持静息状态的机制,比如E.Llorens-Bobadilla等2015年利用二代测序技术,从成体脑室管膜下区中分离出几种神经干细胞并对其单细胞基因表达谱进行了分析,发现这些细胞对大脑急性缺血性损伤的反应各不相同。这些处于从静息到激活之间各种状态的干细胞共存于一个干细胞巢内。单细胞基因表达谱的分析为解释干细胞静息状态的维持和激活机制提供了重要的资料。
但是静息干细胞由于缺乏明确的分子标志而且数量较少,所以分离和鉴定都非常困难,而通过组织损伤等手段分离获得的干细胞往往被认为是被激活的干细胞。
3.过渡放大细胞的增殖速率远高于干细胞
在发育过程中,当新的组织和器官形成需要时,干细胞分裂会相应加快,但是,当机体成熟,干细胞分裂会逐渐变慢,并逐渐进入静息状态,以避免成熟前过度消耗和减少突变概率。
过渡放大细胞(transit amplifying cell,TAC)是激活的干细胞经过不对称分裂产生的位于干细胞和分化细胞之间的一种细胞类型(图17-6),具有一定的分化潜能,所以也有人将其称为过渡放大前体细胞(transit amplifying progenitor cell,TAP),其主要特性就是其增殖速率显著高于干细胞。
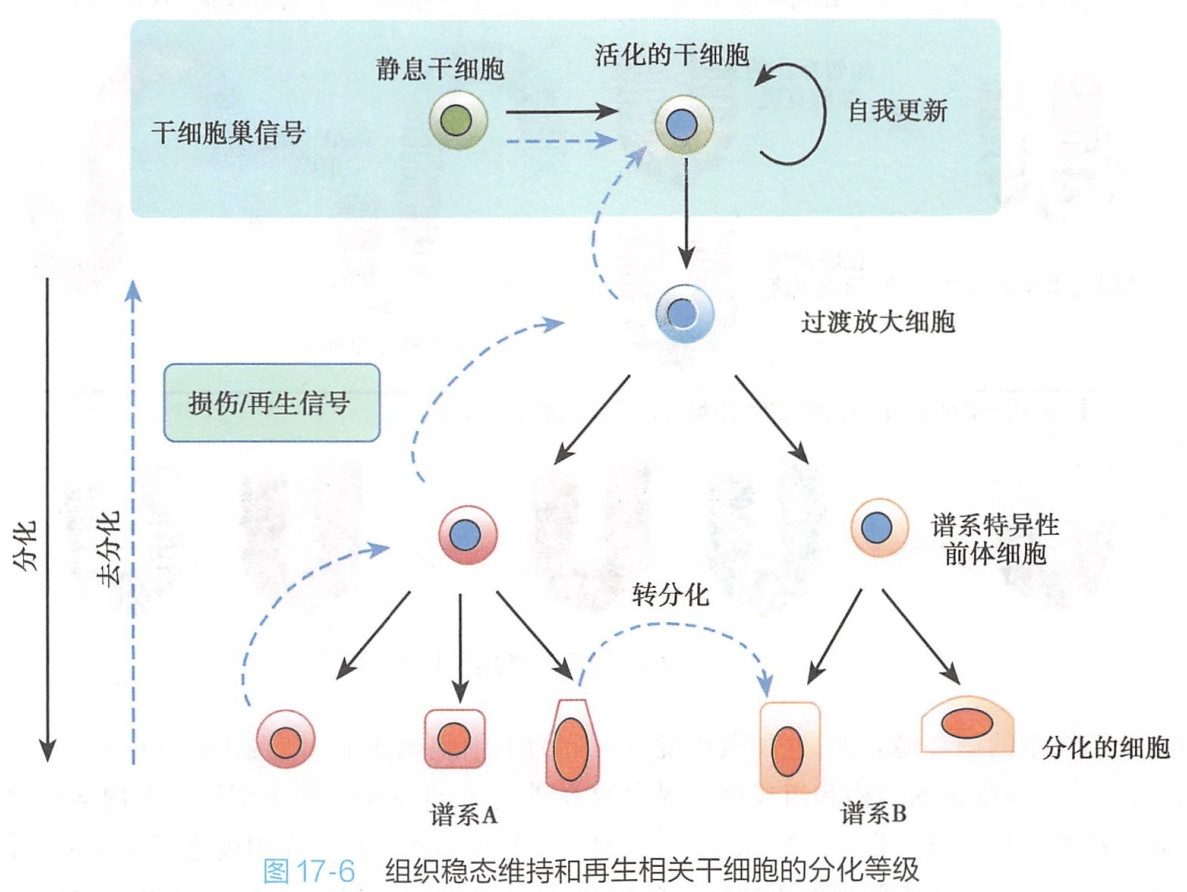
如小肠过渡放大细胞比小肠干细胞分裂速度大约快一倍。目前发现有很多组织干细胞都会通过不对称分裂产生过渡放大细胞,包括人和小鼠的角膜干细胞、人乳腺干细胞、前列腺上皮、哺乳动物表皮、胃肠道干细胞、哺乳动物毛囊干细胞等。
一方面,干细胞可以借助这种不对称分裂,保持自身干细胞特性和数目的稳定性,另一方面可以借助于过渡放大细胞较高的增殖速率和分化潜能来增加分化细胞的数目,以满足组织更新或修复的需要。
例如小鼠表皮基底层的干细胞所产生的过渡放大细胞对维持表皮的组织稳态有重要作用。表皮基底层细胞通过不对称分裂产生一个子代细胞(干细胞)保留在基底层,另一个子代细胞位于基底上层,也就是会快速分裂的过渡放大细胞。由于不对称分裂,基底层的干细胞数目能够保持稳定,而过渡放大细胞的数量快速上升,并继而分化产生新的表皮层或进行组织修复。可以观察到在成层活动发生时,在基底表皮层中,有丝分裂纺锤体超过70%的是垂直朝向基底膜的。
(二)组织干细胞分化具有很强的可塑性
1.组织干细胞的分化具有谱系限定性
在个体发育的整个过程中,其个体的各种组织中都有干细胞的存在,处于不同发育阶段和不同组织器官中的干细胞的分化潜能,则具有严格的谱系限定性。
一种组织干细胞它通常只能分化产生其所在组织内的或与之相应的特定功能的细胞,即只产生其细胞谱系以内的细胞类型,而不产生其他组织中的细胞类型,如小肠干细胞可分化产生小肠组织细胞(即吸收细胞、杯细胞、嗜酸细胞和肠内分泌细胞),神经干细胞只能产生神经组织细胞(即神经元、星形胶质细胞或少突胶质细胞)。
干细胞(包括全能干细胞、多能干细胞和位于各种成体组织中的组织特异性干细胞)分化谱系的限定性有其复杂而严格的调控机制。
2.组织干细胞的分化潜能又可称之为干细胞分化的可塑性
可塑性是指细胞对外源和内源因子作出反应从而改变细胞现有状况的能力。从分化的角度,干细胞的分化潜能又可称之为细胞的可塑性,比如神经干细胞可以分化为神经元、星形胶质细胞和少突胶质细胞。而在某些特殊的条件下,神经干细胞的分化为造血细胞,甚至有的研究结果提示植入小鼠胚胎内的神经干细胞可以分化成三个胚层来源的细胞,这也是干细胞分化的可塑性。
3.分化细胞可以通过去分化过程获得组织干细胞可塑性
一般认为,组织和器官稳态的维持主要是靠组织干细胞的增殖和分化来补充或替代受损细胞来实现,但近年来研究表明,内源性的非干细胞在组织更新中的作用也是非常重要的,该结论在三肠涡虫、两栖类、鱼类、甚至是哺乳动物非上皮组织中都得到了证实。
非干细胞参与损伤组织的修复主要是通过自身的去分化和转分化的过程实现的,这也可以说是组织细胞的“可塑性”。
所谓去分化(dedifferentiation),是指分化细胞失去原来的分化特性获得了同样组织谱系的前体细胞的能力,而转分化(transdifferentiation),是指分化细胞在某个既定的组织中变成了相同组织谱系的分化细胞(图17-6)。虽然转分化的过程中似乎并不涉及干细胞可塑性的获得,但是也并不排除该组织细胞经过了短暂的干细胞阶段然后形成另外一种组织细胞的可能性。
近年来细胞重编程(cellular reprogramming)领域的发展也支持了包括干细胞在内的许多其他类型的细胞的分化行为的可塑性,研究人员可以在体外对干细胞或分化细胞进行各种诱导转变,除了转分化和去分化,还可以将一种分化细胞直接诱导为另一细胞谱系的干细胞。
但是人们最关心的还是在体内,分化末端的细胞是否能通过转分化和去分化从而获得干细胞的特性,然后行使组织干细胞在组织修复中的作用呢?目前很多利用谱系示踪(lineage tracing)方法进行的体内研究,从多个角度证实了体内分化细胞的可塑性。比如小肠中Lgr5+小肠干细胞的活动是正常生理状况下小肠隐窝维持的主要成员,它能分化成多种细胞,其中Bim1+细胞就是由Lgr5+小肠干细胞分化而来,但是在小肠干细胞-巢单元受到破坏时,Bim1+细胞能通过去分化形成新干细胞池行使干细胞功能(图17-7):
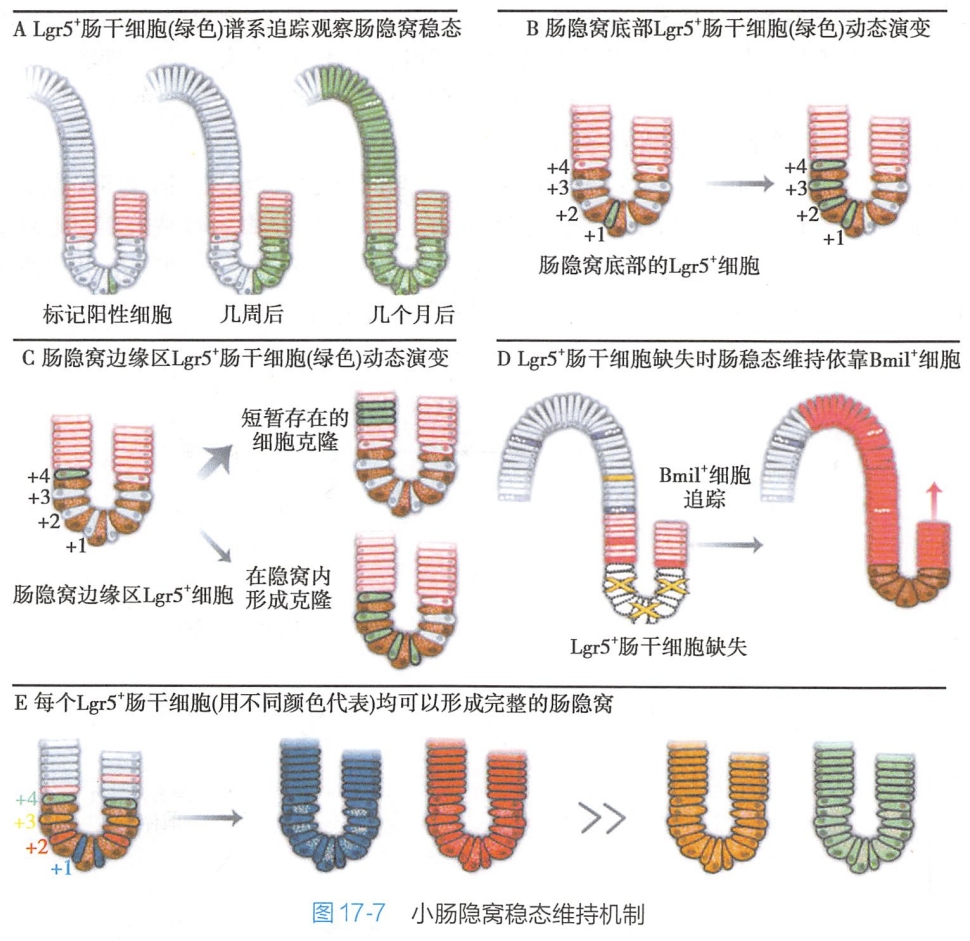
哺乳动物成体肾中的上皮细胞可以通过去分化执行肾修复的功能;在毒物损伤和胆管结扎的情况下,成熟肝细胞可以转分化为胆管细胞。据此有人提出组织特异性的再生策略除了“干细胞策略”外,如何在体内或体外唤醒分化细胞的可塑性也是值得深入探讨的。
二、组织干细胞生理活动的微环境
增殖与分化是调控组织中干细胞群体稳定性的基本方式,也是调控组织器官结构和功能动态平衡的基本方式。目前一般认为,干细胞的增殖与分化存在一个严密的调控机制,这个调控机制可能就与它所在的组织中的微环境有关,这种微环境也可称为干细胞巢或干细胞龛(stem cell niche)。
目前已经知道,不同干细胞巢的结构和组成存在很大的差别,这也许就是不同干细胞的生物学行为都受到特定机制调控的结构基础。目前一般认为,干细胞巢中各种因素的相互作用决定了干细胞的休眠、增殖或分化状态的转变。
干细胞巢的重要性还体现在,即使在没有干细胞的情况下(如通过照射治疗去除干细胞后),干细胞巢的微环境仍可保留其关键作用,允许招募外源性干细胞并使其归巢到原有的干细胞巢。
由于干细胞与赖以生存和维持功能的微环境之间不可分割的关系,所以目前经常会用“干细胞-巢单元”(stem cell-niche unit)来代替“干细胞巢”或“干细胞龛”的惯用名词。
(一)“干细胞-巢单元”由执行不同功能的异源性成员组成
1.干细胞-巢单元不仅仅指干细胞的定居的物理位置
各种组织干细胞的存在虽然都有相对固定的组织学部位,但干细胞-巢单元却不仅仅是指干细胞定居的物理部位。
这里是干细胞与外源性信号发生相互作用的场所,在结构上是一个由干细胞及其外围细胞、细胞外基质以及参与其增殖分化调控的相关因子所组成的,并具有动态平衡特性的局部环境(图17-8)
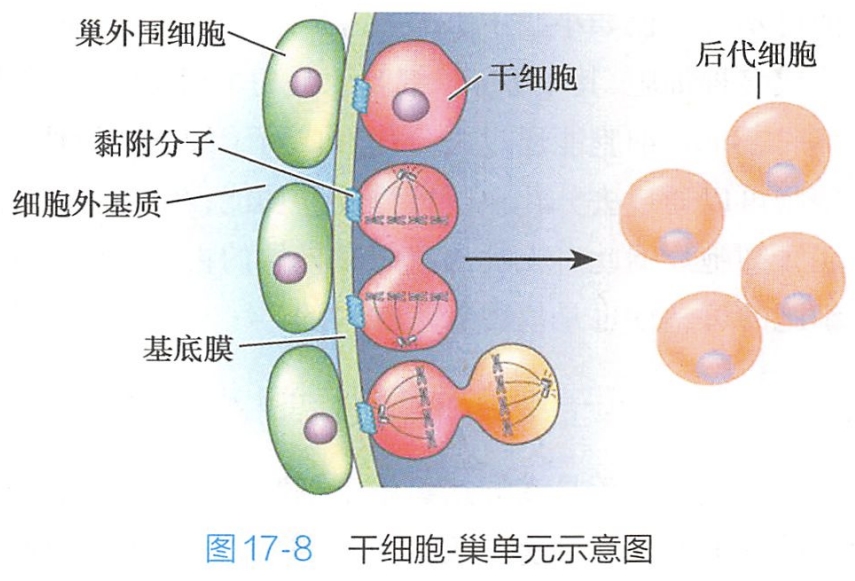
2.整联蛋白和胞外基质参与干细胞巢单元的结构体系的形成
整联蛋白(integrin)是一类细胞黏附分子,其作用依赖于Ca2+,介导细胞与细胞间的相互作用以及细胞与细胞外基质间的相互作用。几乎所有动植物细胞均表达整联蛋白。其中细胞与胞外基质的附着可以由多种受体介导,但目前认识最多的是整联蛋白。
高表达β-整联蛋白对维持表皮干细胞(epidermal stem cell)的增殖分化至关重要。β-整联蛋白还通过MAP激酶(mitogen-activated protein kinase,MAPK)途径调节角质化细胞等细胞的分化。
此外,整联蛋白有维系干细胞在组织中空间位置的作用,否则干细胞会脱离生存环境而分化或凋亡。
胞外基质还有调节干细胞微环境中局部分泌因子浓度的作用,整联蛋白的激活和表达也要受胞外基质蛋白的调节。
3.干细胞-巢单元中的分泌因子是干细胞增殖分化的调控因子
在干细胞-巢单元中,分泌因子(secreted factors)可以是干细胞自身分祕的,也可以来自外围细胞或者其他组织细胞。它们对于干细胞增殖与分化的调控具有重要作用。在不同的干细胞微环境中,以及不同的生理或发育状态下,分泌因子的种类及其水平可有很大差别,但这种差异总是与机体发育或生理状态的需求是相适应的。目前发现,TGF-β(transforming growth factor beta)和Wnt家族的信号分子在多种干细胞的不对称分裂以及维持干细胞自我更新方面起重要作用。
4.干细胞-巢单元中过渡放大细胞和分化的子代细胞对干细胞产生反馈调控
由于细胞不对称分裂产生的过渡放大细胞也成为干细胞-巢单元的一个组成部分。目前认为干细胞-巢单元成员通过刺激活化的干细胞进行分裂从而建立“过渡放大细胞池”(TAC pool),过渡放大细胞池又能够反过来作为信号中心提供某些干细胞-巢单元信号,从而调控干细胞的增殖状态,体现出调控的“双向性”。
最近的研究提出一些分化的干细胞后代也能够作为巢成员并对干细胞产生反馈调控。例如,造血系统中,分化的巨噬细胞归巢到骨髓后,能增强造血干细胞的滞留,限制其向外周血移动。总之,目前认为,处于分化末端的子代细胞形成的“谱系反馈循环”在其所处的干细胞-巢单元中发挥调控干细胞分化的作用。
(二)器官水平上各干细胞巢单元之间存在协同作用
“干细胞-巢单元”的研究让我们了解到干细胞-巢单元和干细胞之间相互作用的基本模式,但是放眼于器官或组织再生、重塑等问题的研究,研究人员不能忽略的是散布在整个组织和器官的所有干细胞-巢单元之间的相互协同作用。这些单元组成成员的分子特性、分裂模式、群体大小的差异非常大。
目前也有越来越多的研究结果支持大部分自我更新的组织是受到多维度干细胞-巢单元的支持的,所以组织和器官更新过程所面临的挑战呈现多层次的特点,不但包括单个干细胞-巢单元内部的调控,还包括组织和器官中所有巢之间的协同调控。
三、几种组织干细胞的研究现状
(一)造血干细胞
造血干细胞在所有骨髓细胞中所占的实际比例很少,但它们却具有强大的增殖和分化能力。有研究表明,一个单独的造血干细胞就可以重建整个造血系统。在哺乳动物的个体发育中,造血干细胞最早被发现于早期胚胎的卵黄囊囊壁的血岛(blood island)中,随后被发现于“主动脉-性腺-中肾”(Aorta-gonad-mesonephros,AGM)区,进而被发现于肝和脾中,最后被发现于骨髓中。骨髓是胚胎中后期和出生后整个生命期间的造血场所。
造血干细胞的分离纯化可以通过表面标志来实现。目前比较明确的人造血干细胞的表面标志有 CD34+、CD38-、Lin-、HLA-、DR-、Thy+、c-Kit+、CD45RA-和CD71-等。其中,CD34是临床上应用最多的造血干细胞标志物。
造血干细胞特性的维持与细胞分化方向的抉择与造血微环境有着密切的关系。研究发现,在哺乳动物骨髓中,一部分HSC存在于骨小梁的骨内膜区,紧靠成骨细胞:另一部分HSC与血窦周围的血管内皮细胞相连。这提示HSC栖息于两种微环境——成骨巢和血管周围巢。
研究显示成骨巢维持 HSC的静态,成骨细胞提供了调节HSC数量及功能所需的调节因子;血管巢调控HSC的增殖、分化和动员等行为。
目前临床上常用的骨髓移植或造血干细胞移植疗法,实际上就是利用了造血干细胞可以再殖(repopulate)损伤骨髓的生物学特性。这种疗法在白血病的治疗中取得巨大的成功,使白血病患者的长期生存率提高到50%~70%,其疗效远远地胜于化疗。美国医学家托马斯(E.D.Thomas)于1956年成功执行了世界上首例人类骨髓移植手术,他也因此而获得了1990年度的诺贝尔医学奖。
(二)间充质干细胞
间充质干细胞(mesenchymal stem cell,MSC)起源于胚胎期中胚层的间充质,已发现在许多由间充质分化来的成体组织都可以分离出来,包括脂肪组织、胎盘、皮肤、脐带血、脐带血管周细胞、牙髓、羊水、滑膜,以及母乳等。目前已有的研究结果证明了间充质干细胞的多向分化潜能,在体内或体外特定的诱导条件下,可分化为脂肪、骨、软骨、肌肉、肌腱、韧带、神经、肝、心肌、内皮等多种组织细胞。
尽管间充质干细胞的研究已有很多,但这些研究大多是基于培养的间充质干细胞的体外研究,而MSC的体内鉴定则迟迟没有令人信服的方法和结论,所以关于间充质干细胞的基本生物学特性的认识基本上都是体外培养的间充质干细胞的特性。
不同来源的MSC的生物学特性存在着一定差异,这与组织来源,供体种属特性、分离技术,培养条件以及传代次数都有关系。MSC的基本特性是:
- 能够在塑料培养皿l上黏附生长;
- 具有“三向分化”(tri-lineage differentiation)潜能,即脂肪细胞、软骨细胞和成骨细胞。
- 在此基础上,还要求具有的特性是,其细胞表面表达CD105(endoglin,SH2)、CD73(ecto-50-nucleotidase)及CD90(Thy1)等分子标志,不表达CD45、 CD19或CD79、CD14或CD11b及HLA-DR等分子标志。
尽管这样,单就MSC的鉴定来说,目前存在的一个最大的问题仍然是缺乏特异性的分子标志。
在近十年中,虽然间充质干细胞的基础研究仍存在很多问题,但是间充质干细胞临床应用却得到飞速发展,成为了干细胞研究中的热点领域之一,主要应用包括:
- 造血干细胞移植,包括增强造血功能,促使造血干细胞移植物的植入,治疗移植物抗宿主病。
- 组织损伤的修复,包括骨、软骨、关节损伤,心脏损伤;肝脏损伤;脊髓损伤和神经系统疾病。
- 自身免疫性疾病,包括系统性红斑狼疮、硬皮病、炎性肠炎等。
- 作为基因治疗的载体。
有学者认为,MSC在临床应用方面取得如此大的发展,很大一方面原因并不因为它的干细胞性质,而是得益于MSC的免疫调节功能,这一独特的性质使临床研究为异基因型MSC的移植打开了方便之门。
(三)神经干细胞
哺乳动物胚胎发育中,在神经外胚层形成后,神经分化就开始了。在邻近神经诱导信号的作用下,神经外胚层形成一个盘样结构,称为神经盘。最早的神经干细胞就位于神经盘中。
传统观点认为,哺乳动物的中枢神经系统在出生后不久就丧失其再生能力,成人脑组织一经损伤就不能再生。然而,近些年的研究发现,在大多数成体哺乳动物神经系统的侧脑室壁的室管膜下区(subventricular zone,SVZ)和海马齿状回的颗粒下区(subgranular zone,SGZ)有神经干细胞(neural stem clls,NSC)的存在(图17-9、图17-10)。
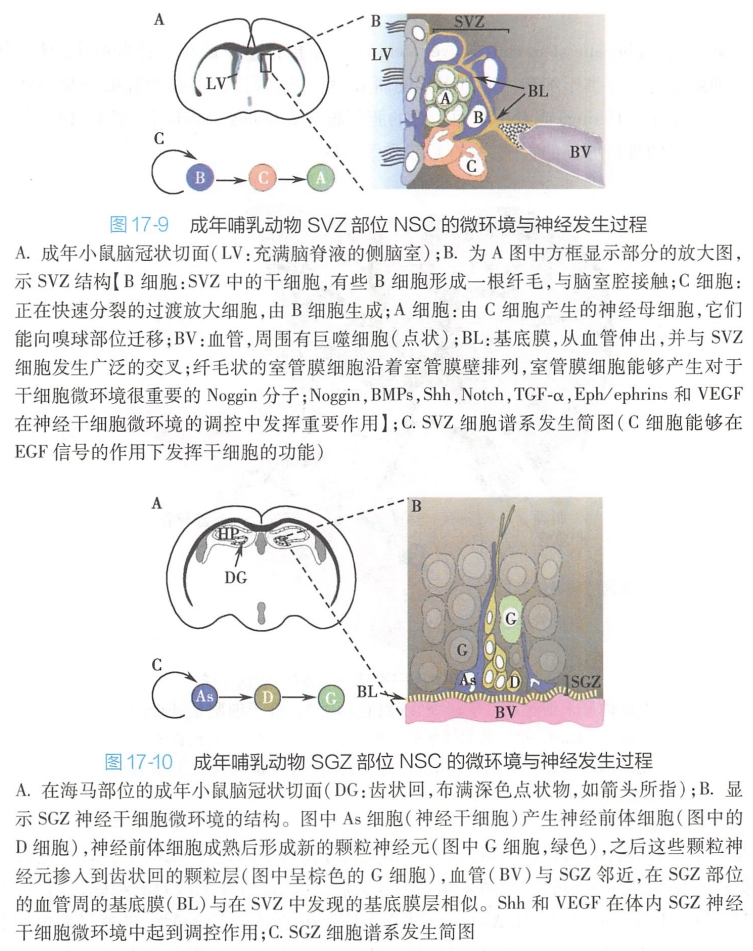
NSC具有自我更新能力和分化产生成熟神经元、星形胶质细胞和少突胶质细胞的潜能,由此而赋予了成年个体整个生命期间神经系统特定结构和功能维持的基础。在正常生理情况下,SVZ NSC通常处于静息状态。但在损伤或其他特定病理情况下,这种细胞可以分化产生增殖性的过渡放大细胞,进而可以产生具有迁移特性的神经母细胞(neuroblast)。然后,神经母细胞可以通过由胶质细胞所形成的轨道网络从SVZ区域向嗅球迁移。
在海马齿状回SGZ区域中的NSC的分子标志与SVZ NSC相似,而且也可以分化为神经元,但其产生的过程有些特殊性。
SVZ和SGZ这两个神经干细胞微环境中,主要包括下述细胞组分:
- 星形胶质细胞,该细胞是微环境中的主要细胞组成成分;
- 基底膜以及伴随基底膜生成的血管,它们是微环境中的重要成分;
- 在微环境中存在着某些“胚胎”形态发生因子,这些因子在成年个体的神经发生中发挥重要作用。
NSC的体外培养:细胞在EGF存在的条件下以非贴壁的球形(可称其为“神经球”)的方式生长,当在生长因子被撤出后,就可分化为神经元和胶质细胞。
(四)肝脏干细胞
肝脏起源于前肠内胚层,与胚胎心脏相接触的前肠部分受到来自心脏间充质细胞分泌的FGF家族细胞因子的作用而形成肝脏的原基。在肝的原基中,存在肝脏的前体细胞也被称为肝母细胞(hepatoblast)。
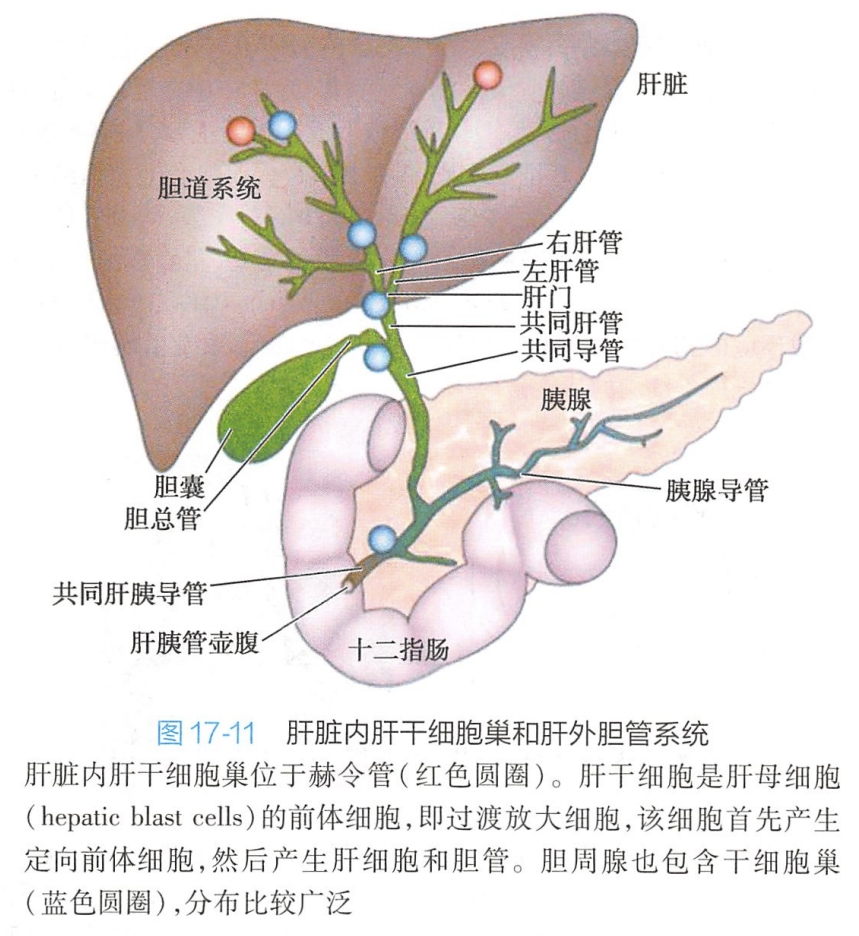
成体肝脏干细胞(hepatic stem cell或liver stem cell)是指存在于成年个体肝脏中,具有分化为肝细胞和胆管细胞能力的一类干细胞。通过多年的研究,目前通常认为存在于肝细胞和小叶内胆管交界处的赫令管(canal of Hering)或者小叶间胆管的胆管腺(peribiliary gland)上(图17-11),但是成体肝干细胞对肝脏稳态的维持方面的贡献,一直是颇受争议的。
肝脏是一个十分独特的器官。与造血、小肠和皮肤等器官不同,生理状况下肝脏细胞的新旧更替是通过成熟的肝细胞和胆管细胞的增殖来实现的,特别是已高度分化的成熟肝细胞,具有强大的增殖能力。
在一些慢性药物损伤中,肝细胞也发挥了主要的修复作用。肝细胞强大的自我修复能力削弱甚至掩盖了肝干细胞的贡献。虽然目前还没有发现肝干细胞在2/3切除后的肝再生过程中起作用,也没有证据表明肝干细胞在肝脏的生理性更新中起作用,但是,有些实验室观察到在经典肝损伤模型中,源于胆管的肝干/前体细胞,可以一定程度的参与肝脏损伤修复,分化为成熟肝细胞或者胆管细胞。
随着近年来体内细胞示踪技术的发展,许多研究团队陆续证明了成体肝脏中不同细胞的作用,这也同时揭示了肝脏稳态维持机制的复杂性,肝细胞,肝星状细胞,胆管细胞在不同的肝损伤情况下都有可能参与肝脏的修复。
(五)精原干细胞
精原干细胞(spermatogonial stem cell)存在于睾丸曲细精管内,紧贴于曲细精管的基底膜。精原干细胞在曲细精管内的精原细胞(spermatogonium)中所占的比例很小,是分化程度最低的一类原始细胞,它是精子发生的细胞基础,对维持睾丸曲细精管结构和功能的稳定与平衡具有重要作用。精原干细胞是研究较早、较多的组织干细胞。
精原干细胞是精子发生的细胞基础。[200 学习/201 细胞生物学/第14章 生殖细胞/第1节 生殖细胞/生殖细胞#二、精子的发生|精子发生]的全过程都发生在睾丸的曲细精管内。对于所有哺乳动物来说,其精子发生都遵循这一基本规律。但目前已经知道,精子发生的细节在哺乳动物的不同物种之间则存在一定的差异,而这种差异主要存在于从精原干细胞到初级精母细胞形成的这一分化阶段。
人和非灵长类动物的精子发生过程的细节目前尚不十分明确。研究表明,基底膜的曲细精管上皮含有未分化型的精原干细胞(Adark and Apale)和分化型精原干细胞(B型)。Adark是最初的精原干细胞,它经过Apale阶段而分化为B型细胞。B型精原干细胞产生初级精母细胞进入减数分裂并从基底膜移出,后续经减数分裂和精子发生依次产生精母细胞、精子细胞、和终末分化的精子,并释放到曲细精管的管腔。
精原干细胞的分化具有一个复杂的调控机制。目前已获较多进展,如已发现Kit受体是精原细胞分化早期的一个关键的调控因素,而干细胞因子(stem cell factor,SCF)是Kit受体的配体,它可通过Kit受体促进细胞增殖。而且已经知道,精原细胞能表达Kit受体,而支持细胞表达其配体SCF。