胚胎干细胞
在个体发育的囊胚阶段,其囊胚腔中的内细胞团细胞具有多向分化潜能,它可以分化为胎儿或成体组织中的各种细胞类型。若采用实验的手段,将内细胞团细胞分离出来,并将其在体外稳定培养,所得到的这种细胞就是一般所说是的胚胎干细胞(ES细胞)。
胚胎干细胞的另一个来源是原肠胚之后的原始性腺中分离获得的,也被称为EG细胞(embryonic germ cell),与ES细胞具有相似的性质。 #组胚
一、胚胎干细胞的生物学特性
胚胎干细胞为未分化多能性细胞,它可表达早期胚胎细胞的分子标记,但在不同的物种之间,其表面抗原的表达情况可有很大的差异。
此外,分离自内细胞团发育阶段之后的早期胚胎中的具有多向分化潜能的EG细胞(embryonic germ cll),由于细胞所处的发育阶段不同,其分子标志与胚胎干细胞也是不完全一致的。例如,人EG细胞可表达SSEA-1,但人胚胎干细胞则不表达SSEA-1。
(一)胚胎干细胞体外培养中呈现克隆化生长和快速增殖的特性
胚胎干细胞具有原始细胞的形态和生化特征。胚胎干细胞的体积较小,核质比例较大,内质网及高尔基复合体等细胞器不发达。在囊胚中,它们以致密的集落样的形式(即内细胞团)生长,并附着于囊胚的内侧壁。
在体外培养的条件下,胚胎干细胞的体积仍然很小,核质比例很大,核中可有多个核仁,它们也是以致密的集落样的形式生长,形似鸟巢。
胚胎干细胞可以在体外无限扩增,增殖迅速,可以进行传代、遗传操作和冻存,表现并保持稳定的、正常的二倍体核型。现在已经知道,各种哺乳动物的胚胎干细胞在体外培养条件下都具有相似的形态特征。
(二)胚胎干细胞具有向三个胚层分化的潜能
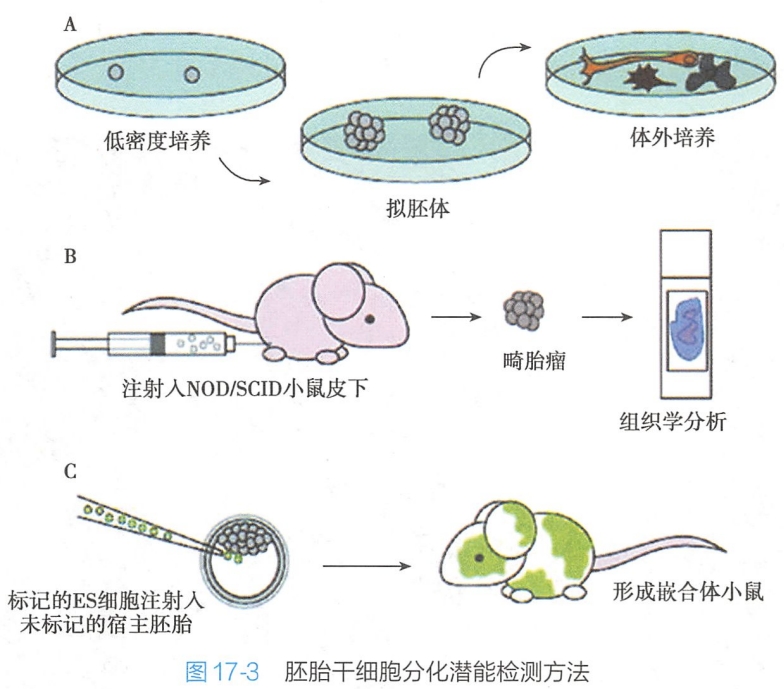
在个体发育中,存在于囊胚内细胞团中的干细胞具有分化为后续发育个体的任何组织细胞的潜能。由于胚胎干细胞体外培养的成功,这一概念已经通过实验的方法得到了充分的证实。其大致的做法有三个方面(图17-3):
- 将培养的胚胎干细胞在体外条件下进行诱导分化,然后观察其分化的情况。
- 例如,将人胚胎干细胞在没有胎鼠成纤维细胞作为饲养层的条件下进行培养,其胚胎干细胞就会发生分化,而且在其培养液中还可以检测到α-甲胎蛋白和人绒毛膜促性腺激素(hCG)的存在,这表明有向内胚层和滋养层方向分化的现象发生。 #组胚
- 又如,将胚胎生殖细胞置于白血病抑制因子存在的条件下,其中的部分细胞能分化成胚状体(embroyoid body,曾称类胚体、拟胚体)。在所形成的类胚体中,可以发现有属于三个胚层的各种类型的分化细胞的存在,这就说明了胚胎生殖细胞具有多能性干细胞的特性。
- 将体外培养的胚胎干细胞移植到免疫缺陷型小鼠的皮下,然后观察是否可以形成混合组织瘤。例如,将人胚胎干细胞移植到重症联合免疫缺陷小鼠的皮下,其移植细胞就可以产生胚胎组织瘤,而且在其瘤组织中观察到了胃上皮(内胚层),骨和软骨组织、平滑肌和横纹肌(中胚层),神经表皮、神经节及复层鳞状上皮(外胚层)等细胞的存在,这就提示了人胚胎干细胞具有形成内、中、外三个胚层的潜能。
- “嵌合体”实验。将体外培养的胚胎干细胞移植到小鼠囊胚腔中,观察植入的细胞是否可以分化为各组织细胞。通过显微注射法,将体外培养的小鼠胚胎干细胞植入小鼠的囊胚腔,使其参与内细胞团的继续发育,进而通过对发育小鼠的各种组织的分析,发现组成这些组织的细胞有些来源于植入囊胚腔的外源ES细胞,故称该小鼠为“嵌合体小鼠”。该实验证明了胚胎干细胞确实具有分化为包括生殖细胞在内的各种组织细胞的潜能。这种形成“嵌合体”的实验被认为是证明ES细胞多分化潜能的“金标准”。
不论小鼠还是人类,细胞的多能性主要由一个以转录因子Oct4为核心,同时包括Sox2与Nanog的多能性网络调控。尽管该多能性环路在人与小鼠多能干细胞中相对保守,但多能性因子的下游通路以及相应的精细调控可能并不完全一致。
二、胚胎干细胞的体外分化
一般认为,ESC的分化受到内源性和外源性因素的共同调节。
- 内源性因素即不同基因在不同时间和空间的开启和关闭,涉及各种转录因子的作用。
- 外源性因素则是指细胞间的分化诱导、分化抑制作用及细胞外物质的介导作用。
ESC的分化研究分为一般诱导分化和定向诱导分化两类。
- 前者是指加入一定的分化诱导剂,常用的是全反式维甲酸(RA),ESC就可以同时或先后分化出不同类型的细胞,这反映了ESC不受约束的自我分化,应用意义不大。
- 目前主要目标是针对不同的终末目标细胞,通过改进培养方式、选择分化诱导剂,研究ESC的定向分化。目前已报道的由ESC诱导分化的细胞主要有造血细胞、心肌细胞、神经细胞、脂肪细胞、胰岛细胞、内皮细胞、上皮细胞、肝细胞、成骨细胞和软骨细胞、胰岛素分泌细胞等等。目前的研究方法大约分成两大类:
- 一种方法是胚状体的诱导分化。先诱导胚胎干细胞形成胚状体,然后再从胚状体中分离所需要的目标细胞,进而扩大培养获得一定数量的目标细胞。胚状体通常由具有三个胚层特性的衍生物所组成,可以认为是大多数成熟体细胞系的前体细胞。
- 第二种方法是不经过胚状体,而是利用单层培养的ES细胞,直接诱导获得目标细胞,当然这种诱导往往要经过分步诱导才能完成。
(一)将ESC诱导分化为中胚层细胞
胚状体形成之后,可将其调整为一般的正置状态进行培养,使其附着于培养皿的表面上生长,这时有可能在胚状体上观察到个别正在发生“搏动”的区域。在随后的正置贴壁培养中,可以看到大片状的、呈同步收缩的细胞。在具有收缩特性的细胞群中,反映心脏不同特殊功能的细胞可以用电生理方法检测出来,包括心房样细胞、心室样细胞、浦肯野细胞样细胞和结细胞样细胞。
胚胎干细胞的治疗在从实验室研究到临床应用之前,还有许多问题需要解决,其中最为重要的一点就是要证实,由胚胎干细胞分化产生的各种类型的分化细胞是否具有与宿主组织之间发生完全的功能性整合的能力。
(二)将ESC细胞诱导分化为外胚层细胞
依据发育生物学的基本理论,现已在体外建立起了一套化学成分确定的人类多能干细胞向神经定向分化的诱导系统,能较好地模拟了人类神经发育早期的主要过程,且时间区分明显,各时期的标记物清楚,是研究人类神经发育的良好模型。
例如,由ES细胞形成的胚状体在不加额外的诱导因子的情况下,细胞在第7天开始表达转录因子Pax6(Paired box protein6)。如果生长于培养皿面上,这些早期的神经上皮细胞于一周后形成明显的花环状结构,并开始表达其他神经系的标记物如Soxl。激活FGF信号通路,或抑制SMAD通路,会明显促神经分化。
细胞表达Pax6但尚未表达Soxl时,它们能在塑型因子的作用下被定向分化至特定细胞谱系。例如,在视黄酸RA作用下,本来向颅侧分化的细胞转而向脊髓分化。但是,RA能对细胞起作用的时间窗口往往非常短暂,只有几天时间,一旦细胞开始表达Soxl,这些细胞便不能再被分化为脊髓细胞。
小鼠胚胎干细胞向神经外胚层的分化相对容易,目前已有几种不同的方案来得到大量的神经元样、星形胶质细胞样或少突胶质细胞样细胞。这些方案可以不必经过胚状体的步骤,而是直接通过胚胎干细胞的单细胞层培养的方式,使其分化为神经外胚层细胞。这种分化方案可以将超过80%的人多能干细胞转变为PAX6+神经系细胞,进而能分化为各种细胞亚类。有研究表明,这些分化细胞被植入小鼠模型后,仍然具有功能活性(即可以形成突触并产生动作电位),而且能够整合入大脑,并可纠正某些神经变性疾病的表型。
(三)将ESC细胞诱导分化为内胚层细胞
由于在胚胎发育过程中,内胚层的出现最晚,所以其细胞特化过程较为复杂,所以ES细胞的体外诱导分化获得内胚层细胞,理论上也更困难一些。
三、诱导性多潜能干细胞
2006年,日本科学家山中伸弥团队成功地利用病毒载体转染将四个转录因子Klf4、Sox2、Oct4及c-MyC导入小鼠成纤维细胞获得了多潜能细胞。仅仅一年后,人的多潜能细胞也通过相同的转录因子体系或不含有c-MyC的转录因子体系而成功建立,
这些重编程的多潜能细胞现在被称为诱导性多潜能干细胞(induced Pluripotent Stem Cells,iPSCs)。虽然这些人iPS细胞的多潜能性质与人ES细胞并不完全一致,但是他们的确在形态和分化能力上面与人ES细胞极其相似,比如在体外能分化成三胚层而且能在免疫缺陷小鼠体内形成畸胎瘤。
人们最初对iPS的兴趣主要集中在iPS细胞在药物筛选、模拟人类疾病和病人个体化治疗方面的潜在应用前景上。最初的诱导体系使用了逆转录或慢病毒载体基因转导体系来构建iPS细胞,其潜在的不利后果是转基因可随机插入到基因组中,可能会破坏正常基因表达,所以后来很多实验室的工作集中在如何避免使用病毒和不引起插入突变方面。
最近出现的方法中有利用非整合型质粒载体和可移除的转座子进行基因转染的,有通过直接导入转录因子重组蛋白的方法进行重编程的。 #生化
比较有临床应用价值的是利用某些小分子化合物来诱导细胞重编程为iPS细胞的方法。通过高通量药物筛选可以获得这些有效小分子的最佳组合,这种方法由于诱导成分明确而且没有外源基因的导入,安全性会更高。
虽然目前还没有利用iPS治疗疾病的临床前和临床实验报道,但是由于其来自于病人自身,使用中不会产生免疫排斥反应,使得iPS细胞在某些疾病治疗方面显示出ES细胞所没有的优越性。对某些遗传缺陷的病人,可以将他们的iPS细胞进行基因打靶或者基因编辑技术对基因缺陷进行修复,然后再移植到病人体内,达到恢复正常基因功能的目的,这种设想在小鼠镰刀型贫血症的治疗中已经取得成功。基因修正的iPS细胞来源的肺前体细胞也同样被证明在治疗遗传突变引起的肺病,像囊性纤维化、α1-抗胰蛋白酶缺乏,和表面活性蛋白不足等疾病治疗中具有很好的效果。