细胞自噬
一、细胞自噬的定义与分类
(一)细胞自噬的定义
自噬源于古代希腊语,是“auto”(自我)与“phagy”(吞噬)的结合,顾名思义是细胞的自我消化。自噬是指胞质内大分子物质和细胞器在膜包囊泡中大量降解的生物学过程。
目前的研究认为,细胞自噬只发生在细胞进入周期后,静止期细胞对自噬诱导因素不敏感。
在自噬过程中,部分或整个细胞质、细胞器被包裹进双层膜的囊泡,形成自噬泡(autophagic vacuole)或自噬体(autophagosome)(图16-10)。
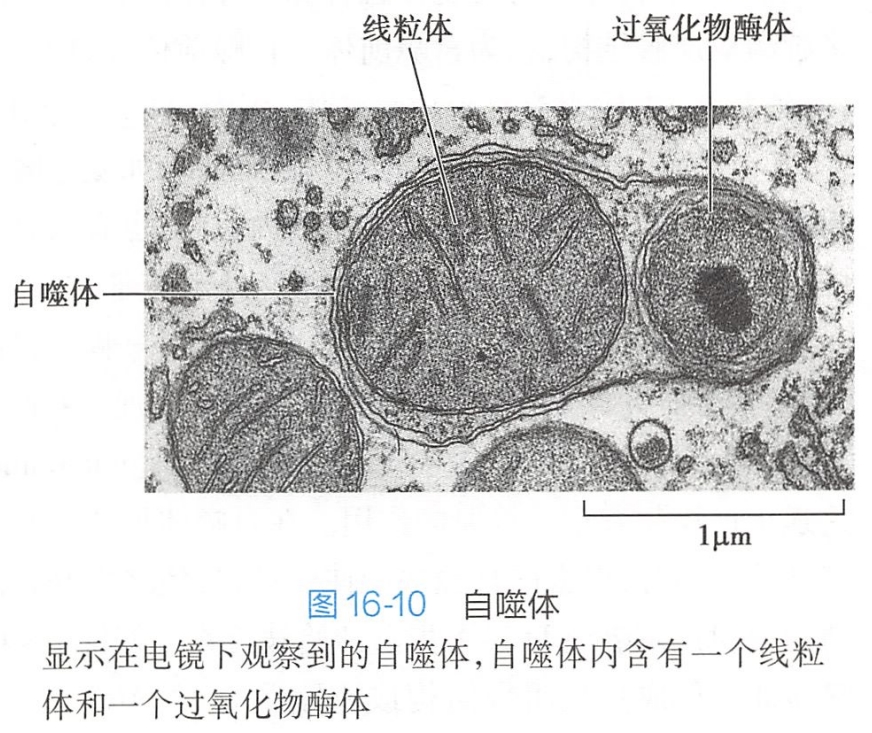
自噬体形成后很快变成单层膜,然后与溶酶体结合形成自噬溶酶体(autoph- agolysosome or autolysosome)。
在自噬溶酶体中,待降解的物质在多种酶的作用下分解成氨基酸和核苷酸等,进入三羧酸循环,产生小分子和能量,再被细胞所利用,实现细胞本身的代谢需要和细胞器的更新。所以,自噬作用在消化的同时,也为细胞内新细胞器的构建提供原料,即细胞结构的再循环。
研究表明,细胞自噬与生物体的发育、分化相关,尤其是在低等生物中,受到环境胁迫因子的影响可以诱导细胞自噬现象的产生。因此,长期以来细胞自噬被认为是细胞的自救行为。
自噬可以帮助细胞抵抗衰老、饥饿等外界压力,但过度的自噬又将导致细胞发生程序性死亡,被称为Ⅱ型凋亡。在某些条件下,细胞自噬也能导致细胞死亡,并证明细胞自噬的发生受多种基因的调控,如ATG(autophagy-related)基因、蛋白激酶基因和磷酸酶基因等。
自噬对细胞的两面性作用导致其在疾病中起到复杂双刃剑效应。近期研究表明自噬作用在生物体生长发育、细胞分化及对环境应激的应答方面极为关键,对防止某些疾病如肿瘤、肌病、神经退行性疾病以及对抵御病原微生物的感染和延缓衰老、延长寿命等方面发挥重要作用。
在恶性肿瘤中,自噬的作用尚未确定。在恶性肿瘤的进展阶段,自噬可以帮助癌细胞对抗营养缺乏和缺氧,尤其是血供不良的实体性肿瘤。但研究表明,某些抗肿瘤治疗药物有可能通过自噬机制发挥作用,如被广泛用于乳腺癌治疗的药物它莫西芬可能通过激活细胞自噬,由神经酰胺介导上调Beclin 1表达发挥作用。
(二)细胞自噬可区分为几种类型
根据细胞内底物运送到溶酶体腔方式的不同,哺乳动物细胞自噬可分为3种主要类型:微自噬(microautophagy)、巨自噬(macroautophagy)和分子伴侣介导的自噬(chaperone-mediated autophagy, CMA)。
- 巨自噬即通常所指的自噬,是自噬形式中最普遍的一种。巨自噬过程中,细胞质中的可溶性蛋白和变性坏死的细胞器被非溶酶体来源的双层膜结构包裹,即自噬泡,并被自噬泡携带到初级溶酶体中降解加工。
- 微自噬主要是溶酶体的膜直接包裹,如长寿命蛋白并在溶酶体内降解。
- 分子伴侣介导的自噬首先由胞质中的分子伴侣Hsc73识别底物蛋白分子的特定氨基酸序列并与之结合,分子伴侣-底物复合物与溶酶体膜上的受体结合后,转运到溶酶体腔中,被溶酶体酶降解,整个过程不需要囊泡的参与。
CMA的底物是可溶的蛋白分子,所以,CMA降解途径在清除蛋白质时是有选择性的,而前两者无明显的选择性。为此,根据对降解底物的选择性,细胞自噬又分为非选择性自噬和选择性自噬两大类。
- 非选择性自噬中,蛋白质或细胞器被随机运送到溶酶体中降解;
- 而选择性自噬对降解的底物具有专一性,如线粒体自噬(mitophagy)就是这样一种通过自噬机制选择性清除受损伤或不必需的线粒体的过程,以保证细胞正常生命活动的进行。线粒体自噬的异常可能与神经退行性疾病,糖尿病和肿瘤的发生有密切关系。此外,分泌自噬(crinophagy)、过氧化物酶体自噬(pexophagy)、内质网自噬(reticulophagy)、核糖体自噬(ribophagy)、细胞核碎片状自噬(nucleophagy)、蛋白聚集物自噬(aggrephagy)、噬脂(lipophagy)、异源自噬(xenophagy)等都属于有选择性的自噬。这些选择性自噬对特异性底物的清除通常包括两部分:待降解底物的识别与传递和利用自噬核心机制来实现降解。
二、细胞自噬的发生过程与调控
(一)细胞自噬的发生过程
细胞自噬的发生过程主要包括4个阶段,即底物诱导自噬前体(proautophagosome,PAS)的形成、自噬体形成、自噬体与溶酶体融合和自噬体内容物被降解。
在即将发生自噬的细胞胞质中会出现许多游离双层膜结构,称为自噬前体。自噬前体逐渐形成杯状凹陷,包裹细胞质或损伤/衰老的细胞器(如线粒体、内质网等),形成自噬体(图16-11A)。
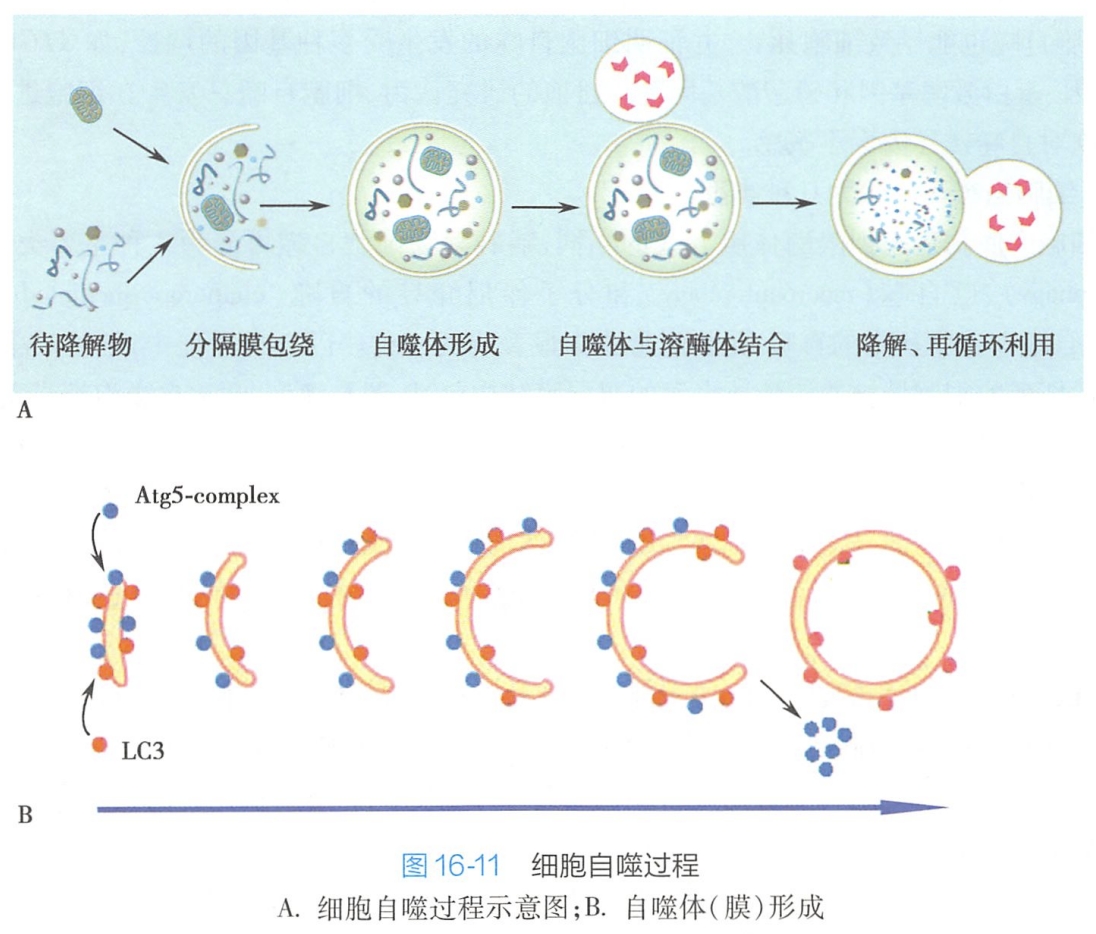
然后与溶酶体融合成自噬溶酶体。在自噬溶酶体中,其内含物被水解酶重新降解成各自底物,如氨基酸、核苷酸等,供细胞重新利用。自噬体双层膜的起源尚不清楚,有人提出来源于粗面内质网,也有人认为来源于晚期高尔基复合体及其膜囊泡,也有可能是重新合成的。
目前已经鉴定出几十种自噬相关基因ATG及其同源物,在哺乳动物自噬体形成过程中,由Atg3、Atg5、Atg7、Atg10、Atg12参与的Atg复合蛋白过程和LC3(microtubule-associated protein1 light chain3,MAP1-LC3)泛素化过程起着至关重要的作用。在自噬体形成的早期阶段,由Atg12-Atg5-Atg16L形成的复合物即与其外膜结合,促进前自噬体的伸展扩张,使之由开始的小囊泡样、杯样结构逐渐发展为半环状、环状结构;
此时,浆溶性LC3-Ⅰ蛋白开始被泛素化修饰成LC3-Ⅱ,并向膜上募集定位。当双层膜结构的自噬体即将形成环状闭合结构或刚刚闭合时,Atg5复合物便从膜上脱离下来,只留下膜结合形式的 LC3-Ⅱ定位于自噬泡膜上(图16-11B)。因此,LC3-Ⅱ含量与自噬体数量的多少成正比,LC3-Ⅱ蛋白表达水平或LC3Ⅱ/I比可以用来衡量细胞自噬水平。
(二)细胞自噬的调控
细胞自噬作为生命现象中重要的生理性反应,其在不同条件下,以不同形式,形成不同程度的“动态平衡”,这种平衡通常受到严格调控,以保持相对稳定。
自噬体的形成依赖于Ⅲ型磷脂酰肌醇三磷酸激酶(Class Ⅲ PI3K)的作用。Class Ⅲ PI3K可磷酸化磷脂酰肌醇(PtdIns),生成3-磷酸磷脂酰肌醇(PtdIns3P)。PtdIns3P募集胞质中含-FYVE-或-PX-基序的蛋白质,用于自噬体膜的形成,由此参与对细胞自噬的正向调控。
此外,Clss Ⅲ PI3K还可与Beclin 1形成复合物参与自噬体的形成。
自噬反应调控路径的TOR信号途径,对细胞生长具有重要调节作用,可抑制自噬反应的发生,是重要的自噬反应直接负反馈调节分子。
肿瘤抑制因子PTEN(为一磷酸酶)可促使PIP3去磷酸化,从而解除Class I PI3K/Akt(PKB)途径对自噬反应的抑制,是自噬反应的间接正反馈调节蛋白。
p53作为重要的肿瘤抑制因子在多种生理和病理状态下参与自噬反应的正、负向调控,提示自噬反应在肿瘤的发生发展过程中起着重要作用。