细胞外基质
细胞外基质是目前了解较清楚的细胞微环境的重要组成成分。构成细胞外基质的大分子种类繁多,大致可分为三类:
- 糖胺聚糖与蛋白聚糖;
- 胶原和弹性蛋白;
- 非胶原糖蛋白:纤连蛋白和层粘连蛋白(图11-1)。
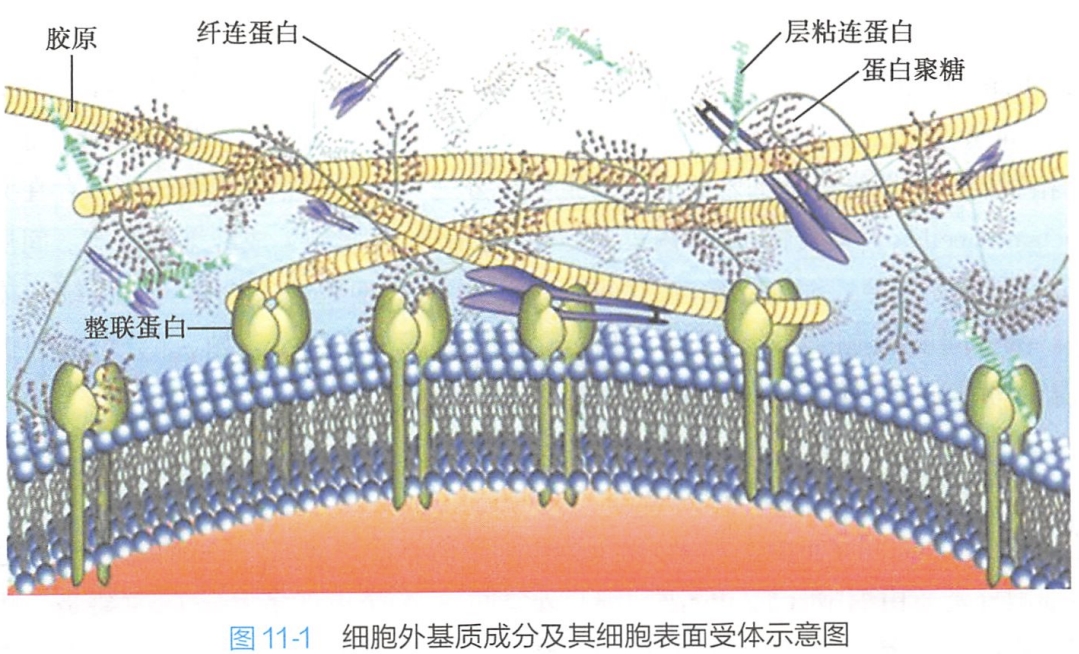
细胞外基质从结构表现形式上看,主要由凝胶样基质和纤维网架构成。糖胺聚糖与蛋白聚糖构成凝胶样基质,纤维网架由起结构作用的胶原和弹性蛋白,以及起黏着作用的纤连蛋白和层粘连蛋白构成。
在动物组织中,细胞外基质的含量因组织种类不同而异,上皮组织、肌组织及脑与脊髓中的细胞外基质含量较少,而结缔组织中细胞外基质含量最大。
细胞外基质的组分及组装形式由所产生的细胞决定,并与组织的特殊功能需要相适应。例如,角膜的细胞外基质为透明柔软的片层,肌腱则坚韧如绳索。
一、糖胺聚糖与蛋白聚糖
糖胺聚糖(glycosaminoglycan,GAG)与蛋白聚糖(proteoglycan,PG)是一些高分子量的含糖化合物,它们构成细胞外高度亲水性的凝胶,赋予组织具有良好的弹性和抗压性。
(一)糖胺聚糖是由重复的二糖单位构成的直链多糖
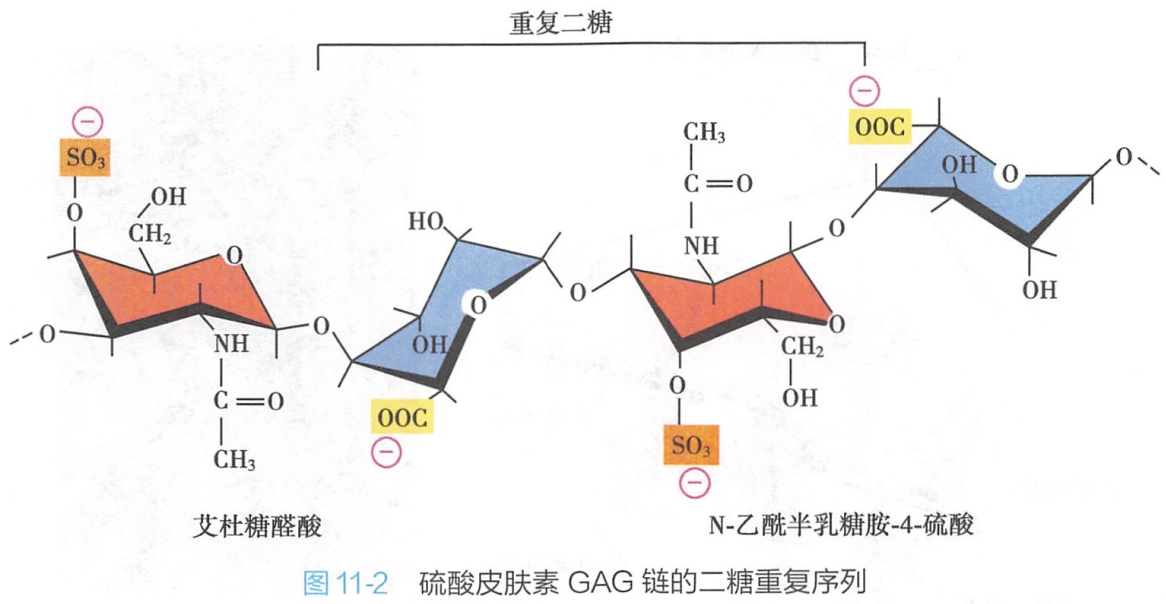
糖胺聚糖是由重复的二糖单位构成的直链多糖,过去称为黏多糖(mucopolysaccharide)。
其二糖单位之一是氨基己糖(N-乙酰氨基葡萄糖或N-乙酰氨基半乳糖),故又称氨基聚糖;二糖单位中另一个糖残基多为糖醛酸(葡萄糖醛酸或艾杜糖醛酸)。因糖残基上通常带有硫酸基团或羧基,因此糖胺聚糖带有大量负电荷(图11-2)。 #有机
根据糖残基的性质、连接方式、硫酸化数量和存在的部位,糖胺聚糖可分为六种:
- 透明质酸(hyaluronic acid,HA);
- 硫酸软骨素(chondroitin sulfate,CS);
- 硫酸皮肤素(dermatan sulfate,DS);
- 硫酸乙酰肝素(heparan sulfate,HS);
- 肝素(heparin);
- 硫酸角质素(keratan sulfate,KS)。其结构、特性及分布见表11-1。

透明质酸(HA)是糖胺聚糖中结构最简单的一种,整个分子全部由葡萄糖醛酸和N-乙酰氨基葡萄糖二糖单位重复排列构成,不发生硫酸化。
由于透明质酸分子表面糖醛酸的羧基带有大量的负电荷,其相斥作用使整个分子伸展膨胀占据很大的空间;其表面的大量亲水基团,可结合大量水分子,使基质等渗性水肿,因而即使浓度很低,也能形成黏稠的胶体。如果没有约束,一个透明质酸分子可以占据1000倍于其自身分子的空间。当处于有限空间时可产生膨胀压,赋予组织具有良好的弹性和抗压性。
透明质酸是一种重要的糖胺聚糖,在胚胎发育早期和组织创伤修复时,细胞大量分泌透明质酸,促进细胞迁移和增殖。任务完成后,可被透明质酸酶(hyaluronidase)降解。
(二)蛋白聚糖
是由糖胺聚糖和核心蛋白共价结合形成的高分子量复合物
1.蛋白聚糖的分子结构
蛋白聚糖是由糖胺聚糖(除透明质酸外)与核心蛋白(core protein)共价结合形成的高分子量复合物,是一种含糖量极高的糖蛋白(含糖量可达分子总重量的90%~ 95%)。
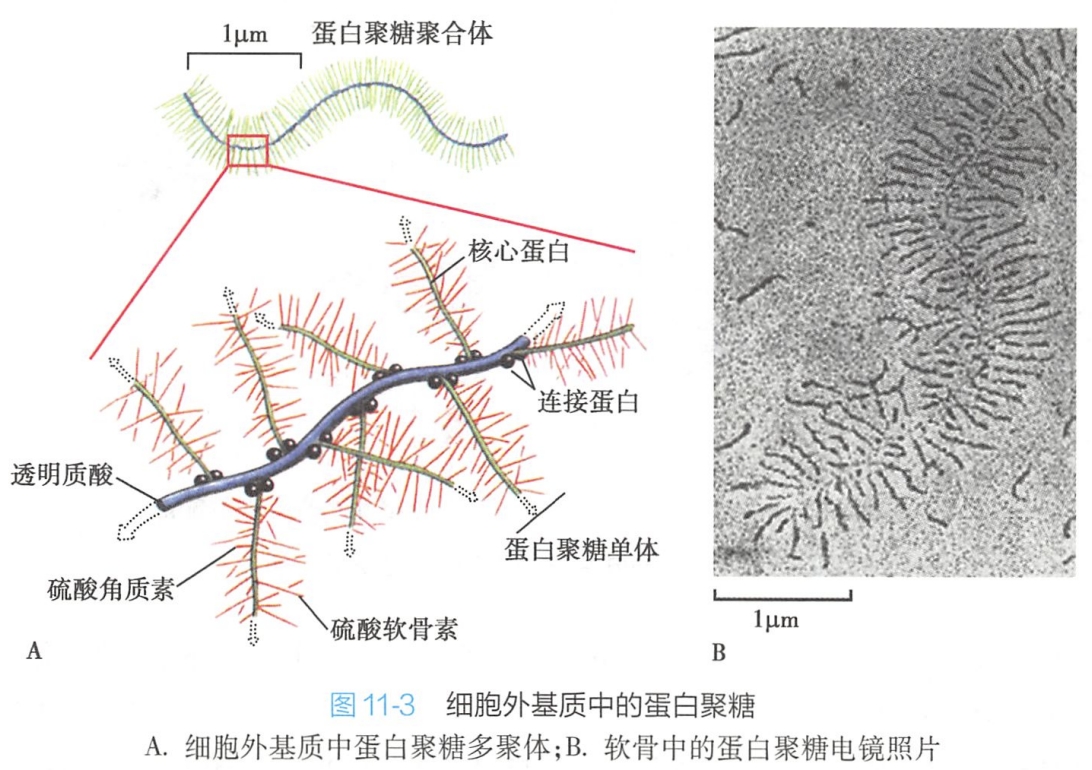
核心蛋白为单链多肽,一条核心蛋白分子上可以连接1~100条以上相同或者不同的糖胺聚糖(糖链较短,一般在300个糖基以下),形成蛋白聚糖单体。
若干个蛋白聚糖单体通过连接蛋白(linker protein)以非共价键与透明质酸结合形成蛋白聚糖多聚体。
软骨中的蛋白聚糖复合体是已知的最巨大分子之一,它的糖胺聚糖为硫酸软骨素和硫酸角质素,每个复合体相对分子量高达数百万,长达几个微米。这些蛋白聚糖赋予软骨凝胶样特性和抗变形能力(图11-3)。
2.蛋白聚糖的合成与装配
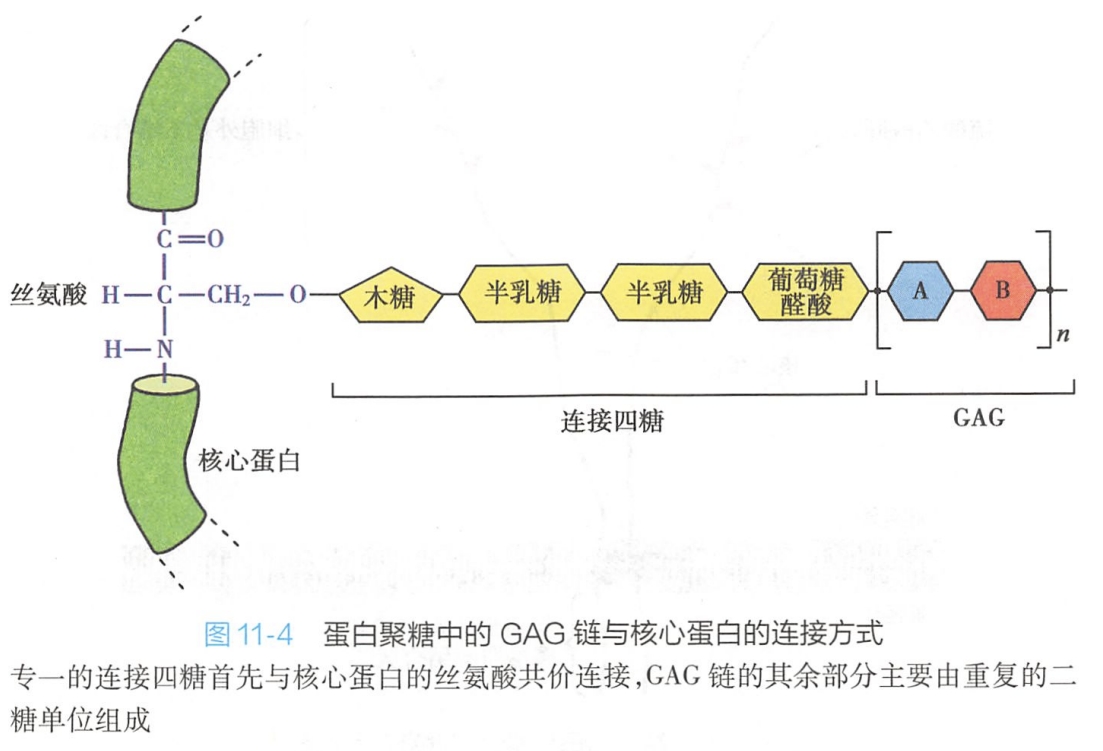
蛋白聚糖的核心蛋白肽链在糙面内质网核糖体上合成,多糖侧链装配到核心蛋白上是在高尔基复合体中进行的。在装配时,首先是一个专一的连接四糖:木糖-半乳糖-半乳糖-葡萄糖醛酸(Xyl-Gal-Gal-GlcUA)与核心蛋白的丝氨酸残基共价结合,在丝氨酸所处的肽链部位具有专一的构象,可被识别。然后在糖基转移酶(glycosyltransferases)的作用下,一个个糖基依次添加上去,形成了糖胺聚糖糖链(图11-4)。
蛋白聚糖的一个显著特点是其多态性,可以含有不同氨基酸序列的核心蛋白,以及长度和成分不同的多糖链。每种蛋白聚糖都有其特有的结构,其功能由各自的核心蛋白和糖胺聚糖所决定。
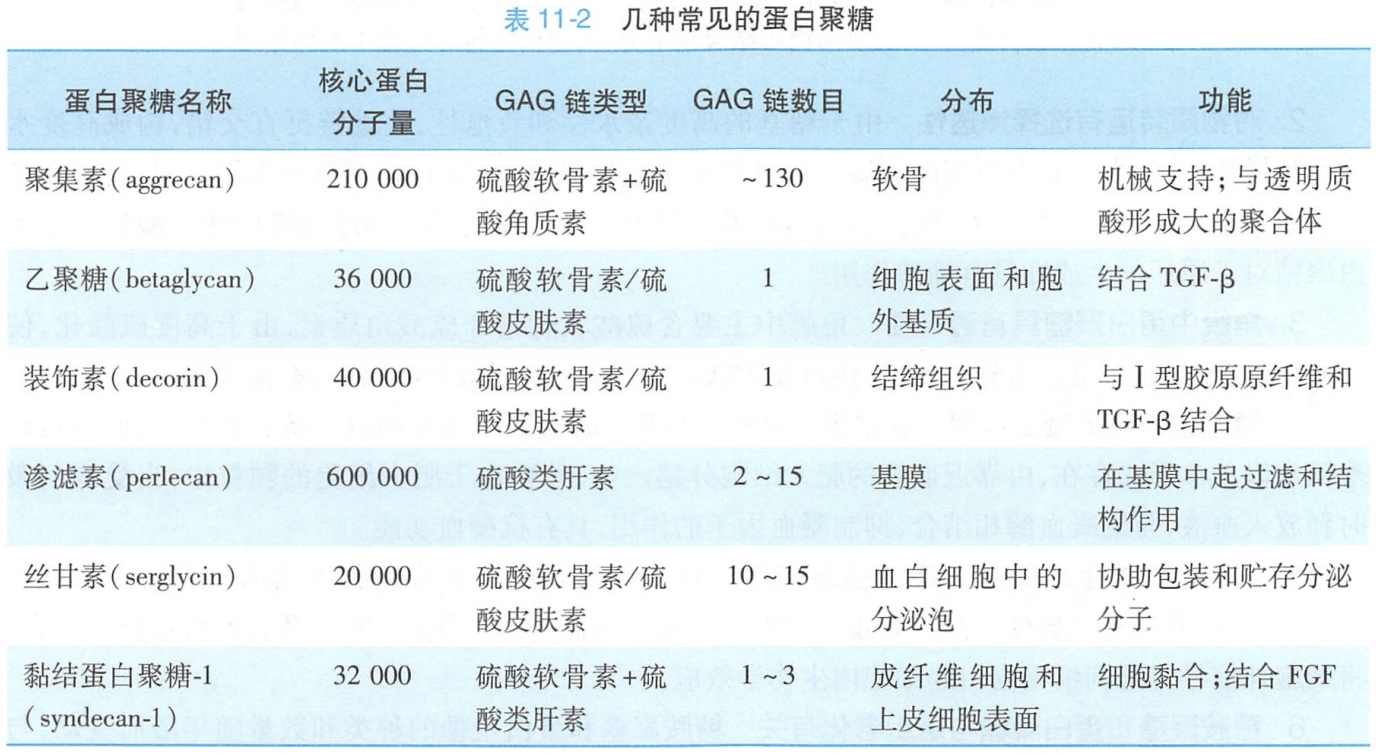
蛋白聚糖并不都是细胞外基质成分,有的也是质膜的整合成分。如成纤维细胞和上皮细胞表面的黏结蛋白聚糖(syndecan),其核心蛋白以穿膜糖蛋白的方式嵌入质膜的脂双分子层中,胞外区连有硫酸软骨素和硫酸类肝素GAG糖链,可以与细胞外基质的胶原、纤连蛋白以及信号分子结合,胞内区肽段可与膜下细胞骨架及细胞皮层内的信号蛋白分子相互作用,既可介导细胞与细胞外基质结合,又可使细胞内外信息相通(图11-5)。
(三)糖胺聚糖与蛋白聚糖的功能
糖胺聚糖和蛋白聚糖普遍存在于动物体内各种组织中,在结缔组织中含量最高。其功能主要有以下几个方面:
1.使组织具有弹性和抗压性
糖胺聚糖和蛋白聚糖构成了细胞外高度水合的凝胶状基质,使组织具有渗透压和膨胀压,有抗张、反弹、抗机械压力的缓冲作用。在维持组织的形态,防止机械损伤中起重要作用。软骨中的蛋白聚糖巨大复合体,赋予软骨具有良好的弹性和抗压性。
2.对物质转运有选择渗透性
由于糖基的高度亲水性和负电性,使糖链挺直交错,构成高度水化孔胶样物,孔的大小和电荷密度可调节对分子及细胞的通透性,具有分子筛的作用。水、离子和各种营养性小分子、代谢物、激素、维生素和细胞因子等可选择性渗透。肾小球基膜中的硫酸软骨素蛋白聚糖对于原尿的生成即具有筛滤作用。 #生理
3.角膜中蛋白聚糖具有透光性
角膜中主要含硫酸软骨素和硫酸角质素,由于高度硫酸化,使基质脱水变得致密,阻止血管的形成,使角膜柔软并具有透光性,同时角质化具有保护作用。
4.糖胺聚糖有抗凝血作用
肝素蛋白聚糖可与某些凝血因子结合而具有抗凝血作用,肝素蛋白聚糖常以单体形式存在,由靠近血管的肥大细胞分泌产生,并贮存于肥大细胞的颗粒中,当受到刺激时释放入血液,与抗凝血酶相结合,抑制凝血因子的作用,具有抗凝血功能。
5.细胞表面的蛋白聚糖有传递信息作用
在成纤维细胞和表皮细胞质膜内的黏结蛋白聚糖(syndecan-1)其胞外区硫酸乙酰肝素蛋白聚糖可与多种细胞外基质蛋白、生长因子等信号分子结合,将细胞外信号传递到细胞内引起细胞内生物学效应。
6.糖胺聚糖和蛋白聚糖与组织老化有关
糖胺聚糖和蛋白聚糖的种类和数量随年龄而变动,与发育过程中组织的功能相适应。如在胚胎发育早期,透明质酸生成特别旺盛,它促进细胞增殖、迁移,并起阻止细胞分化作用。
透明质酸和硫酸软骨素具有很好的保水性,3个月胎儿的皮肤中,透明质酸和硫酸软骨素的含量是成人的20倍,随着年龄的增长,含量逐渐减少,它们的一部分逐渐被硫酸皮肤素取代。关节软骨中的蛋白聚糖随年龄增长而减少,同时硫酸软骨素逐渐被硫酸角质素取代。随着个体的老化,蛋白聚糖中糖链比重下降,导致组织的保水性及弹性减弱,糖胺聚糖和蛋白聚糖变化与老化过程有关。糖胺聚糖的众多阴离子可结合Ca2+,在组织的钙化,尤其是骨盐的沉积中起重要作用。
二、胶原与弹性蛋白
(一)胶原是细胞外基质中的骨架结构
胶原(collagen)是动物体内高度特化的纤维蛋白家族,是人体内含量最丰富的蛋白质,约占人体蛋白质总量的25%以上。它遍布于体内各种器官和组织,在结缔组织中特别丰富,是细胞外基质的框架结构。
胶原可由成纤维细胞、软骨细胞、成骨细胞以及某些上皮细胞合成并分泌到细胞外。
1.胶原的分子结构
典型的胶原分子呈纤维状,是由3条α多肽链盘绕而成的3股螺旋结构,称为原胶原(tropocollagen)。每条α肽链的氨基酸组成和排列独特,含有丰富的甘氨酸(Gly)和脯氨酸(Pro),其中甘氨酸含量占1/3,脯氨酸及羟脯氨酸(Hypro)约占1/4。肽链中的氨基酸组成规律的Gly-X-Y三肽重复顺序(X和Y可以是任何一种氨基酸),但X常为Pro,Y常为Hypro或羟赖氨酸(Hylys)。由于三肽重复顺序中甘氨酸的分子量最小,使肽链卷曲成规律的α-螺旋结构,而肽链的羟基化和糖基化使肽链互相交联,形成稳定的3α-螺旋结构。
2.胶原的类型
α链是原胶原的基本亚单位。每型胶原由3条相同或不同的α链构成,例如I型胶原是异源三聚体,由2条α1(I)和1条α2(I)构成;而Ⅱ型胶原和Ⅲ型胶原是同源三聚体。胶原在体内分布有一定的组织特异性,几种常见的胶原及其组织分布见表11-3。

3.胶原的合成装配与降解
与大多数分泌蛋白的合成、修饰类似,胶原的合成与组装始于内质网,在高尔基复合体中进行修饰,最后在细胞外组装成胶原纤维。
(1)胶原在细胞内的合成
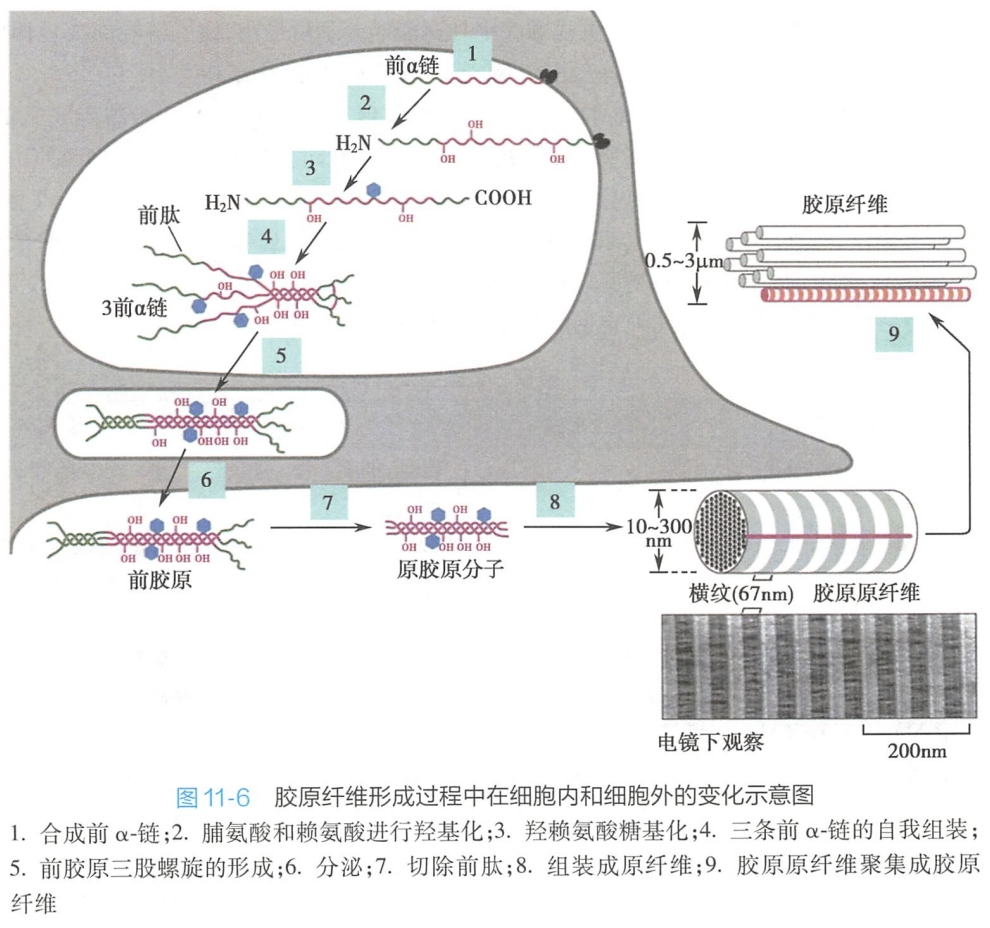
胶原合成时,首先在糙面内质网附着核糖体上合成前α链(pro-α-chain)。前α链不仅含有内质网信号肽,而且在其N端和C端还各含有一段不含Gly-X-Y序列的前肽(prepeptide)。新合成的前链进入内质网腔后信号肽被切除,肽链中的脯氨酸和赖氨酸被羟基化成羟脯氨酸和羟赖氨酸,其中一些羟赖氨酸残基被部分糖基化修饰(其完全糖基化修饰在高尔基复合体中完成)。
随后3条前α链的C端前肽借二硫键形成链间交联,使3条前链对齐排列,并从C端向N端聚合形成三股螺旋结构。这种带前肽的3股螺旋胶原分子称为前胶原(procollagen),其两端的前肽部分保持非螺旋卷曲。(去除前肽就是原胶原。)然后,前胶原分子进入高尔基复合体,经过进一步糖基化修饰,被包装进分泌小泡,分泌到细胞外。
(2)胶原在细胞外的装配
在细胞外,前胶原在两种Zn2+依赖性的前胶原N-蛋白酶和前胶原C-蛋白酶的作用下,分别水解去除两端的前肽,在两端各保留一段非螺旋的端肽区(telopeptide region),形成原胶原分子(tropocollagen)。
随后原胶原分子在细胞外基质中相互呈阶梯式有序排列并发生侧向交联,自组装形成胶原原纤维(collagen fibril)。电镜下胶原原纤维具有典型的67nm明暗相间的周期性条纹。其原因系相邻原胶原分子按1/4长度(约67nm)交错平行排列,前后分子首尾相隔35nm的距离规则排列所致。在细胞外基质中,胶原原纤维常聚集成束,成为直径约0.5~3m甚至更粗的、光镜下可见的胶原纤维(collagen fiber)(图11-6)。
Ⅳ型胶原与Ⅰ、Ⅱ、Ⅲ型胶原不同,在α链中不含规则的三肽重复顺序(Gly-X-Y),因此不形成螺旋结构;分泌到细胞外基质的前胶原分子的前肽不被切除;在装配成高级结构时,二个前胶原分子的羧基端头对头相接形成二聚体,几个二聚体再相互交联成网络,构成基膜的骨架结构。Ⅳ型胶原与层粘连蛋白、硫酸乙酰肝素蛋白聚糖等组装成基膜。
(3)胶原的降解
一般情况下胶原更新转换率较慢,如骨胶原分子的半衰期可达10年。但在创伤修复或炎症反应初期,胶原转换率加快,并伴有胶原类型的转变。胶原分子可被胶原酶(collagenase)降解,胶原酶的活化与抑制对于调节胶原的转换率具有重要作用。激素可调节胶原酶的合成和降解,如糖皮质激素可以诱导胶原酶的合成,雌二醇和孕酮抑制子宫胶原的降解。
4.胶原的功能
(1)胶原在不同组织中行使不同的功能
- 哺乳动物皮肤中的胶原编织成网,分布于皮下结缔组织中,具有抗衡来自不同方向的张力的作用。
- 肌腱起着连接肌肉和骨的作用,在肌腱中的胶原纤维沿着肌腱的长轴平行排列,与承受拉力的方向一致,使肌腱具有很强的韧性,能够承受巨大的拉力。
- 在骨、角膜和横膈肌腱中,胶原纤维形成胶合板样多片层结构,角膜形成有序的胶合板样多片层结构使角膜既透明又具有一定强度。
- Ⅲ型胶原形成微细的纤维网包绕在腺泡、骨骼肌和平滑肌细胞周围。
- Ⅳ型胶原以三维网络形式构成各种上皮细胞基膜的网架结构。
- 胶原通过与细胞外基质中各种成分结合,将细胞外基质组织起来,与细胞表面受体结合,连成组织和器官。
(2)胶原与细胞的增殖和分化有关
胶原有刺激上皮细胞增殖的作用,人体内的细胞绝大多数属于贴附依赖性细胞,即只有在一定的细胞外基质上贴附铺展,才能使细胞增殖周期运行。胶原是细胞贴附的重要基质成分。
胶原还起着诱导细胞分化的作用。如干细胞有多向分化潜能:
- 在Ⅳ型胶原和层粘连蛋白上分化为呈片层极性排列的上皮细胞;
- 在Ⅰ型胶原和纤连蛋白上分化为结缔组织的成纤维细胞;
- 在Ⅱ型胶原及软骨粘连蛋白上则分化为软骨细胞。
(3)哺乳动物在发育的不同阶段表达不同类型的胶原
在胎儿皮肤中含有大量的Ⅲ型胶原,随着发育的进程,Ⅲ型胶原逐渐被I型胶原取代。正常人皮肤中以I型胶原为主。皮肤在损伤后的修复阶段,Ⅲ型胶原含量显著增高。成熟的组织胶原较稳定,半衰期很长,如骨板中胶原分子的半衰期可长达10年。
在创伤修复或炎症反应初期,胶原表达呈现胚胎期特点,胶原分子间缺乏交联。随着年龄增长,分子交联增多,胶原纤维结构逐渐变得紧密,从而导致皮肤、血管及组织变得僵硬,是衰老的重要特征。
5.胶原与疾病
由于胶原的含量、结构、类型或代谢异常而导致的疾病称为胶原病(collagen disease)。如胶原表达过度或分布和比例异常,可造成肝、肺、皮肤病理性纤维化。恶性肿瘤细胞的侵润及转移,与他们能够分泌产生针对Ⅳ胶原的专一性水解酶密切相关;基因突变引起胶原分子结构改变,导致遗传性胶原病等。
维生素C缺乏症:在胶原合成过程中,前α链的羟基化是肽链间互相交联形成稳定的3α-螺旋结构的必需条件,该过程需脯氨酰3羟化酶和脯氨酰4羟化酶的催化,二者均以维生素C为辅助因子。当人体内维生素C缺乏时,可导致胶原前链的羟基化反应不能充分进行,不能形成稳定的3股螺旋结构,随即在细胞内被降解;而原先存在于基质及血管中的正常胶原逐渐丧失,结果导致组织中胶原的缺乏,引起血管、肌腱、皮肤等脆性增加,皮下牙龈易出血及牙齿松动等症状,称为维生素C缺乏症。
(二)弹性蛋白是构成细胞外基质中弹性纤维网络的主要成分
人体一些器官组织在执行生理功能过程中,既需要强度也需要弹性,在受到外力牵拉后可迅速恢复原状,如皮肤、血管和肺组织等,由弹性蛋白形成的弹性纤维网络就赋予组织这种特性。弹性纤维与胶原纤维相互交织,分别赋予组织弹性和抗张性。
弹性蛋白(elastin)是弹性纤维的主要成分,是高度疏水的非糖基化纤维蛋白。它的氨基酸组成像胶原一样富含甘氨酸和脯氨酸,但很少羟化,不含羟赖氨酸,无糖基化修饰。由于肽链中不含胶原特有的三肽(Gy-X-Y)重复序列,故不形成规则的三股螺旋,而呈无规则的卷曲。
弹性蛋白的肽链是由两种类型短肽交替排列构成,一种是疏水性短肽,赋予分子以弹性:另一种短肽为富含丙氨酸和赖氨酸残基的α-螺旋短肽,负责在相邻分子间形成交联。每种短肽各由一个外显子编码。
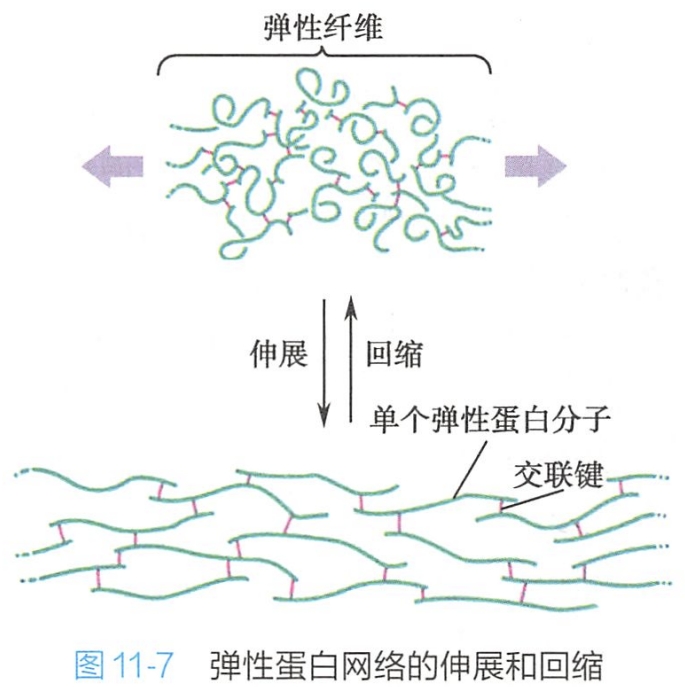
弹性蛋白在细胞中合成后,随即以可溶性前体原弹性蛋白(tropoelastin)的形式分泌到细胞外,通过赖氨酸残基之间相互交联装配成弹性纤维网。由于弹性蛋白的无规则卷曲及高度交联,使弹性纤维网可以像橡皮条一样的伸长与回缩(图11-7)。
弹性蛋白的降解主要由弹性蛋白酶(elastase)催化。
弹性纤维(elastic fiber)并非单纯由弹性蛋白构成,在弹性蛋白的表面还包绕着一层由糖蛋白构成的微原纤维(microfibril)。微原纤维是由一些不同的糖蛋白构成,其中一种较大的糖蛋白是原纤维蛋白(fibrillin),是保持弹性纤维完整性必需的成分。它的基因发生突变可导致一种称为马方综合征(Marfan syndrome)的遗传性疾病。 #遗传 病变累及富含弹性纤维的组织,患者可出现骨骼及关节畸形,身材异常瘦长,严重者容易发生主动脉破裂。
弹性蛋白是动脉中含量最高的细胞外基质蛋白质,可占主动脉干重的50%。
弹性蛋白与无弹性的胶原互相交织,可维持皮肤的韧性,并可防止组织和皮肤过度伸展和撕裂。随着年龄的增长,胶原的交联度越来越大,韧性越来越低,皮肤等组织中弹性蛋白生成减少,降解增强,结果是老年人的骨和关节灵活度下降,皮肤弹性降低起皱。
三、细胞外基质中的非胶原糖蛋白
在细胞外基质中除了胶原和弹性蛋白(非胶原非糖蛋白)两类主要的纤维蛋白外,还含有另一类重要的蛋白成分非胶原糖蛋白。它们都是多功能大分子,在结构上往往具有多个结构域,可与多种细胞及细胞外基质成分结合,是细胞外基质的组织者。
(一)纤连蛋白广泛存在于动物组织中
纤连蛋白(fibronectin,FN)是细胞外基质中发现最早的非胶原糖蛋白,广泛存在于人和动物组织中,是一类含糖的高分子量非胶原糖蛋白,其糖含量因组织不同和分化状态不同而有差异。
纤连蛋白有两种存在形式:
- 一种是可溶性的纤连蛋白,主要存在于血浆及各种体液中,由肝实质细胞分泌产生,少部分产生于血管内皮细胞,称为血浆纤连蛋白(plasma fibronectin);
- 另一种是不溶性的纤连蛋白,主要存在于细胞外基质(包括某些基膜)及细胞表面,主要由间质细胞分泌产生,称之为细胞纤连蛋白。
1.纤连蛋白的分子结构
各种纤连蛋白均由相似的亚单位组成。
血浆纤连蛋白是由两条相似的肽链形成的二聚体(dimer),两条肽链在C端借二硫键交联形成V字形。细胞纤连蛋白为由二聚体交联后形成的多聚体。
纤连蛋白亚单位有多种,是由同一基因编码的产物,转录后由于拼接上的不同而形成多种异型分子,具有不同的生物学功能。不同组织来源的纤连蛋白亚单位在结构上稍有区别,每条肽链构成线性排列的5~6个杆状的功能区,各功能区之间的短肽连接部位可折屈,并对蛋白酶敏感(图11-8),因此可以通过胰蛋白酶的水解作用分离这些功能区之间的短肽,来研究各功能区的功能。研究证实,分离下来的不同的杆状功能区上含有不同的大分子结合位点,可分别与不同的生物大分子或细胞表面受体结合,如可与Ⅰ、Ⅱ、V型胶原、肝素、凝血因子、纤维蛋白(fibrin),以及细胞表面受体如整联蛋白等结合。
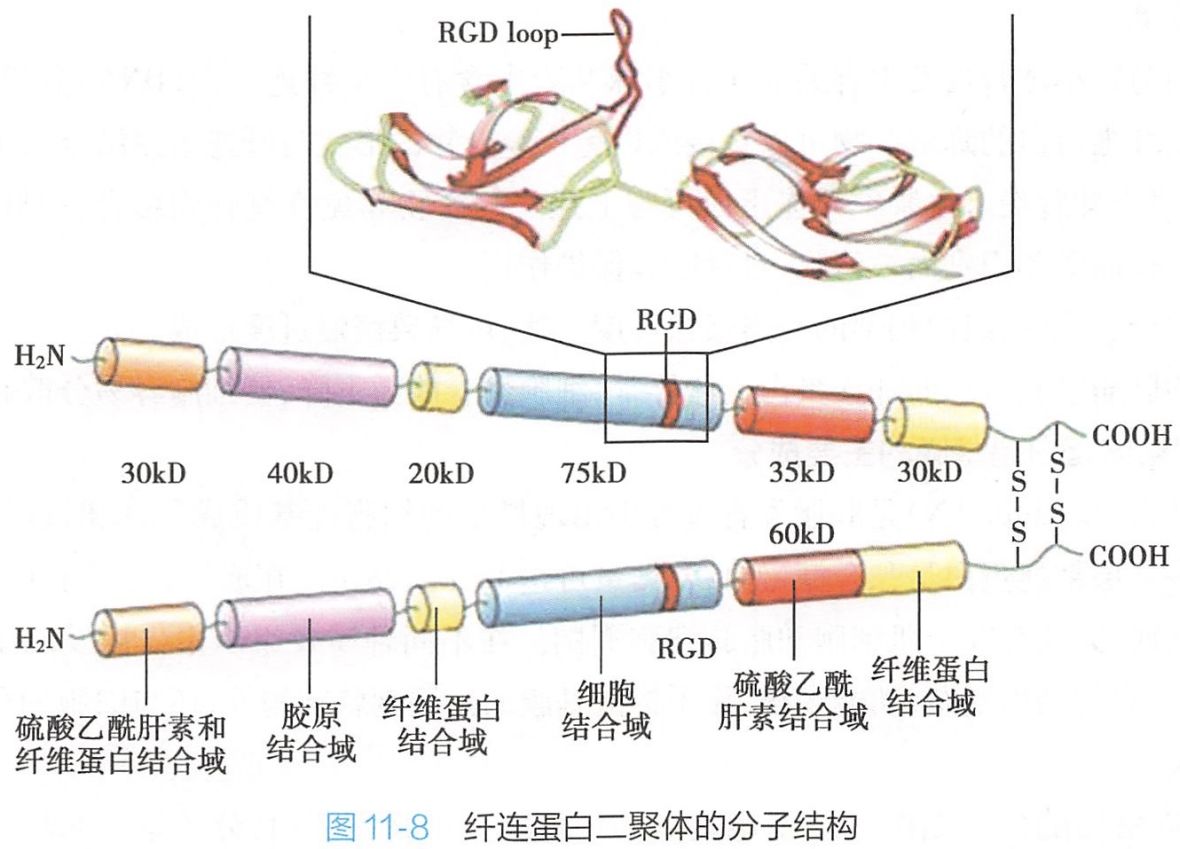
研究表明,纤连蛋白肽链中的某些特殊的短肽序列,如[200 学习/201 细胞生物学/第02章 细胞与分子基础/第2节 细胞的分子基础/生物大分子/蛋白质|Arg-Gly-Asp]三肽是细胞表面各种纤连蛋白受体识别并结合的最小结构单位。如果该结构区发生突变或缺失,则会导致纤连蛋白与细胞的黏附活性显著下降。
一些含有RGD序列的短肽,可与纤连蛋白竞争结合细胞膜上的纤连蛋白受体,因此,这种短肽序列具有抑制细胞同纤连蛋白结合的作用。但RGD序列并不是纤连蛋白所独有的,许多细胞外基质蛋白都含有这种序列。此序列可被细胞表面受体中的整联蛋白所识别。
因此,所谓的RGD序列,是指存在于纤连蛋白和某些细胞外基质蛋白肽链中的“精氨酸(R)-甘氨酸(G)-天冬氨酸(D)”三肽序列。可被细胞表面一些整联蛋白所识别,并与之结合。纤连蛋白的细胞表面受体是整联蛋白家族成员,是一种高分子量的穿膜糖蛋白,由α、β两种亚基(多肽链)组成的异源二聚体,其性质决定了细胞能结合的黏附分子的类型,介导与其他细胞表面或细胞外基质间的黏合(图10-17)。
2.纤连蛋白的功能
纤连蛋白与细胞的形状、黏着、迁移、增殖、分化以及创伤修复、肿瘤转移等均有密切关系。
(1)介导细胞与细胞外基质间的黏着
纤连蛋白分子的多结构域以及其排列的特点,使得它可以同时与细胞外基质中多种生物大分子结合并介导细胞与细胞外基质、细胞之间的相互黏着。通过黏着斑的作用,调节细胞的形状和细胞骨架的装配,促进细胞的铺展,加速细胞的增殖与分化。
(2)纤连蛋白与细胞的迁移
细胞的迁移依赖于细胞的黏附与去黏附以及细胞骨架的组装与去组装。在黏着斑处纤连蛋白受体通过纤连蛋白介导细胞与胞外基质黏附。细胞通过黏着斑的形成与解离,影响细胞骨架的组装与去组装,促进细胞的迁移运动。
在胚胎发育早期,细胞分泌大量的纤连蛋白促进细胞迁移,例如在神经管形成时,神经嵴细胞从神经管的背侧迁移到胚胎特定区域,分化成神经节、色素细胞等不同类型的细胞。
(3)纤连蛋白在组织创伤修复中的作用
血浆中的纤连蛋白能促进血液凝固和创伤面的修复。在组织创伤修复过程中,血浆纤连蛋白能与血浆纤维蛋白结合,在伤口处吸引成纤维细胞、平滑肌细胞和内皮细胞向伤口迁移,形成肉芽组织,然后形成瘢痕,同时还可以刺激上皮细胞增生,使创面修复。
(二)层粘连蛋白是基膜的主要成分
层粘连蛋白(Laminin,LN)是胚胎发育过程中出现最早的细胞外基质成分,同时也是基膜的主要结构组分之一。层粘连蛋白是黏合糖蛋白。在成体,它存在于上皮下和内皮下紧靠细胞基底部,还存在于肌细胞和脂肪细胞周围。在不同种属及组织中先后发现了多种层粘连蛋白异型分子,它们结构复杂,功能多样,除了构成基膜的片层网状结构外,还与细胞的分化、黏附、迁移和增殖有关。
1.层粘连蛋白的分子结构
层粘连蛋白是一种高分子量糖蛋白。层粘连蛋白是由α、β、γ三条不同的多肽链组成的异三聚体。三聚体分子由一条重链(α链)和二条轻链(β、γ链)借二硫键交联而成,外形呈不对称十字形构型,有三条短臂和一条长臂。三条短臂各由三条肽链的N端序列构成。每一短臂上都有相间排列的两个或三个球形结构域和短杆区;层粘连蛋白十字形结构的长臂杆状区域由3条肽链的近C端序列共同构成。其中α链C端肽链序列高度卷曲形成一个较大的球状结构,此为肝素结合的部位(图11-9)。
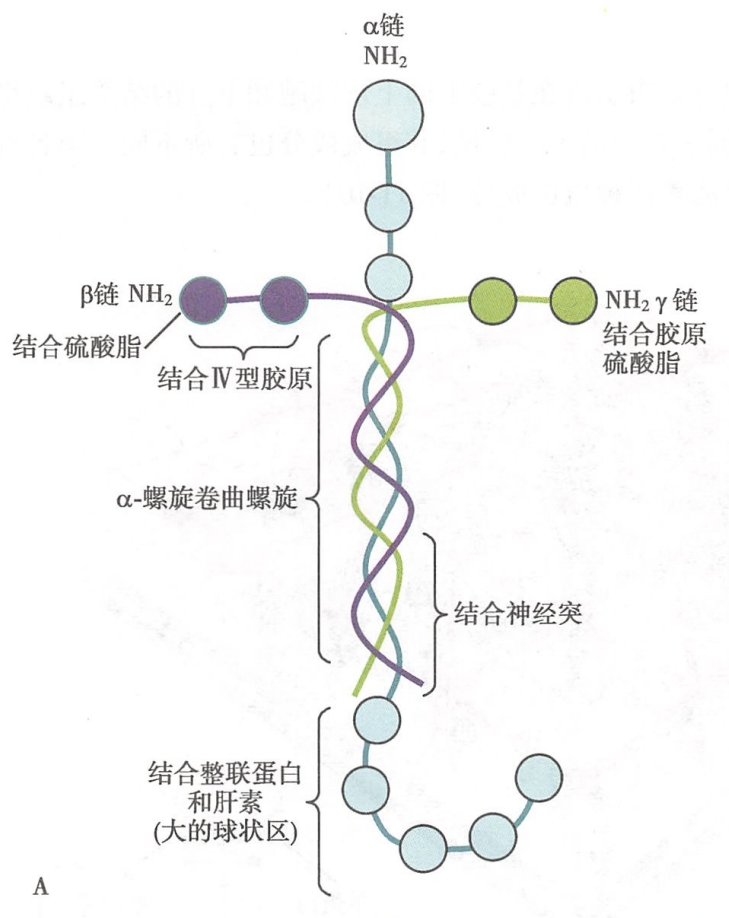
层粘连蛋白分子中存在的多个不同的结构域,可与Ⅳ型胶原、硫酸乙酰肝素、肝素、脑苷脂和神经节苷脂等细胞外基质组分结合,还可通过自身的RGD三肽序列与细胞膜上的整联蛋白结合。
现已证明层粘连蛋白分子中至少有8个与细胞结合的位点,可以分别与上皮细胞、内皮细胞、某些成纤维细胞、神经元、神经鞘细胞以及肿瘤细胞等结合。在层粘连蛋白分子上还发现了能与化脓性链球菌等原核细胞结合的部位。
层粘连蛋白主要由附着在基膜上的上皮细胞和内皮细胞以及被基膜包绕的肌细胞等分泌产生。
层粘连蛋白分布有组织特异性,在不同的组织类型和不同的发育阶段,有不同分子结构的层粘连蛋白表达。
2.层粘连蛋白的功能
层粘连蛋白是基膜的主要组分,在基膜的基本框架的构建和组装中起了关键作用。
层粘连蛋白分子上也有被上皮细胞、内皮细胞、神经细胞、肌细胞以及多种肿瘤细胞表面层粘连蛋白受体识别与结合的RGD三肽序列,使细胞黏附固定在基膜上,促进细胞的生长并使细胞铺展而保持一定的形态。
层粘连蛋白通过与细胞间的相互作用,可直接或间接控制细胞的活动,如细胞的黏附、迁移、分化、增殖或调亡以及基因表达。
层粘连蛋白在早期胚胎中对于保持细胞间的黏附、细胞的极性及细胞的分化具有重要意义。
层粘连蛋白还有助于神经元在体外存活,并可在缺乏神经生长因子的情况下,促进中枢及外周神经元轴突的生长。
四、细胞外基质的特化结构一基膜
基膜(basal lamina或basement membrane)也称基底膜,是细胞外基质的特化结构形式,存在于多种组织之中。它是细胞外基质特化而成的一种柔软、坚韧的网膜结构,以不同的形式存在于不同的组织结构之中。
- 在各种上皮及内皮组织,基膜位于细胞基底部,是细胞基部的支撑垫。
- 在肌肉、脂肪等组织,基膜包绕在细胞周围,将细胞与结缔组织隔离。
- 在肾小球中,基膜介于两层细胞(内皮细胞和足细胞)之间,是滤过膜的主要结构。
- 在胚胎发育过程中,基膜为细胞的分离和分化提供支架;
- 在成年时参与细胞的增殖、分化、迁移和组织损伤修复等过程。
- 基膜是机体抵抗肿瘤细胞转移和侵袭的第一道防线。
(一)基膜的组成成分
构成基膜的绝大多数细胞外基质组分是由坐落在基膜上的上皮细胞和下方的结缔组织细胞合成并分泌的。不同组织器官的基膜,甚至同一基膜的不同区域,其组成成分也有所不同。但各种基膜都含有Ⅳ型胶原、层粘连蛋白、巢蛋白及渗滤素四种蛋白成分(图11-10)。
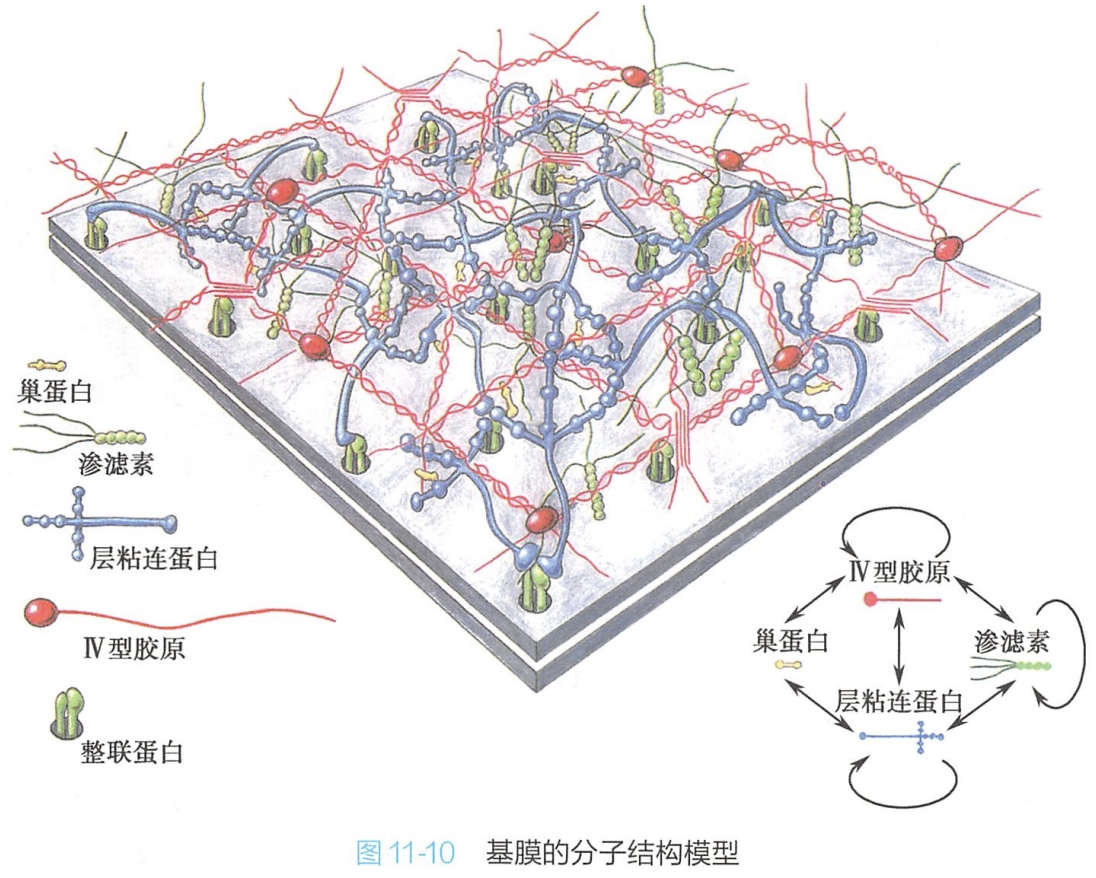
1.Ⅳ型胶原
Ⅳ型胶原是构成基膜的主要结构成分之一,是构成基膜的框架结构。Ⅳ型胶原分子通过C端球状头部之间的非共价键相互作用,以及N端非球状尾部之间的共价交联,形成了构成基膜基本框架的二维网络结构。
2.层粘连蛋白
是基膜中的主要蛋白质成分,由α、β、γ三条肽链构成非对称型十字结构。蛋白之间通过长臂和短臂的臂端相连,自我装配成二维纤维网络结构,并进而通过巢蛋白与Ⅳ型胶原二维网络相连接。细胞质膜中的整联蛋白为其受体。由于层粘连蛋白具有多个不同的功能结构域,既能与Ⅳ型胶原结合,也能与细胞表面受体结合,从而将细胞与基膜紧密结合在一起。
3.巢蛋白(entactin,nidogen)
又称哑铃蛋白,其分子呈哑铃状,具有3个球区,其G3区与层粘连蛋白结合:G2区与Ⅳ型胶原结合,在基膜中形成Ⅳ型胶原纤维网络与层粘连蛋白纤维网络之间的连桥,而且还可以协助细胞外基质中其他成分的结合,在基膜的组装中起着重要的作用。
4.渗滤素(perlecan)
是基膜中最丰富的蛋白聚糖之一,它包含一个巨大的多结构域的核心蛋白质,分子上结合有2~15条特异性的硫酸乙酰肝素链。它可与多种细胞外基质成分(Ⅳ型胶原、层粘连蛋白、纤连蛋白等)以及细胞表面分子交联结合,共同构成基膜的网络结构,肾小球基膜中的渗滤素对于原尿的生成具有筛滤作用。
(二)基膜的生物学功能
基膜不仅对上皮组织起结构支撑作用,而且在上皮组织和结缔组织之间起结构连接作用,同时还具有调节分子通透性以及作为细胞运动的选择性通透屏障。
如在表皮细胞层下的基膜可阻止结缔组织中的成纤维细胞进入表皮,而允许参与免疫作用的白细胞(巨噬细胞、淋巴细胞)穿过基膜进入表皮内;基膜对分子的通透具有高度选择性,如肾小球基膜在原尿形成过程中可以阻挡血液中细胞及蛋白质的透过,起选择性筛滤作用。
此外,细胞的形态、细胞的极性、细胞代谢、质膜上蛋白质的分布、细胞存活、细胞增殖、分化、细胞迁移等许多生命活动现象,均与基膜有着非常密切的关系。