微管
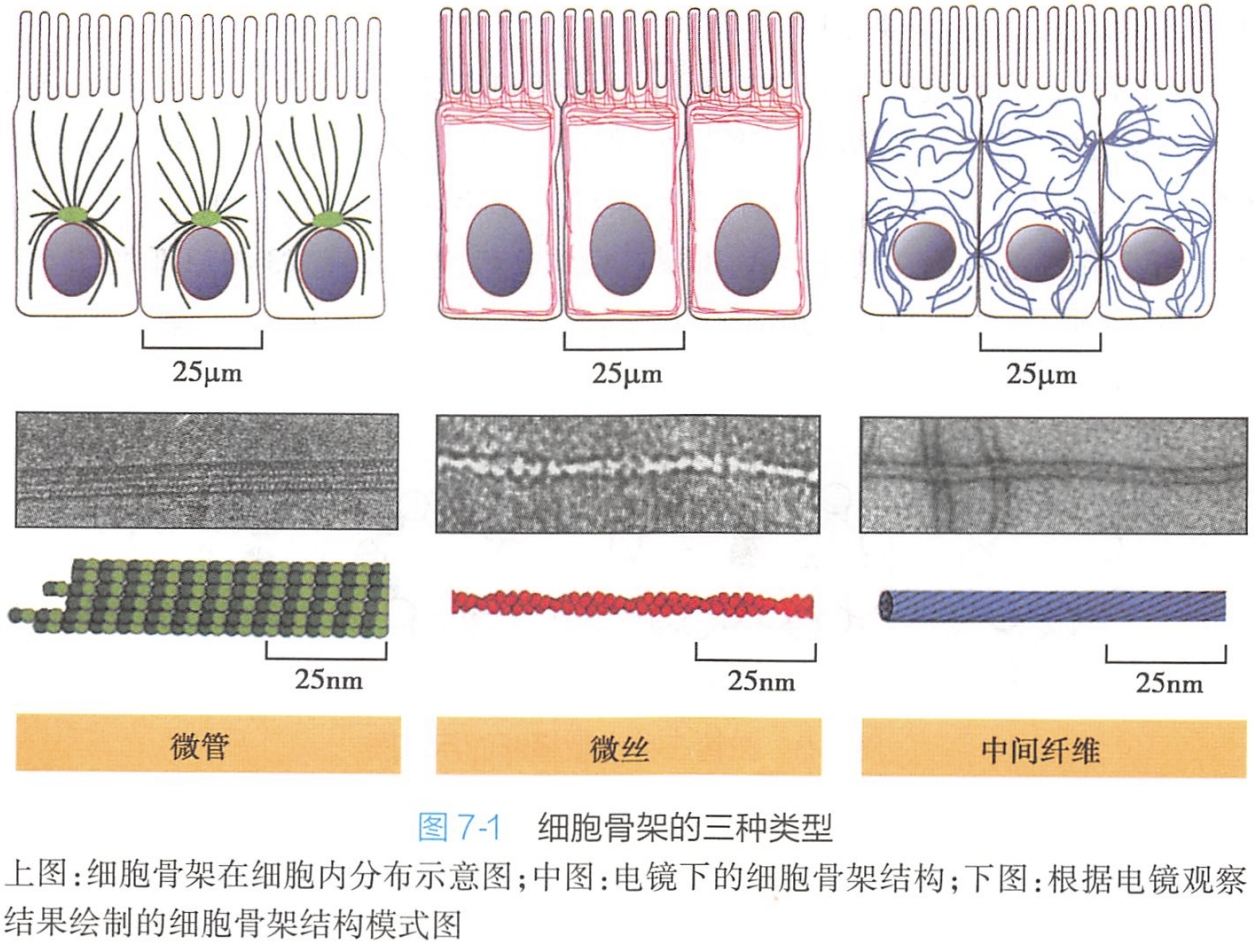
微管(nicrotubule)是由微管蛋白和微管结合蛋白组成的中空圆柱状结构。微管主要存在于细胞质中,控制着膜性细胞器的定位及胞内物质运输。微管还能与其他蛋白质共同装配成纤毛、鞭毛、基体、中心体、纺锤体等结构,参与细胞形态的维持、细胞运动和细胞分裂等。
一、微管蛋白与微管的结构
(一)微管
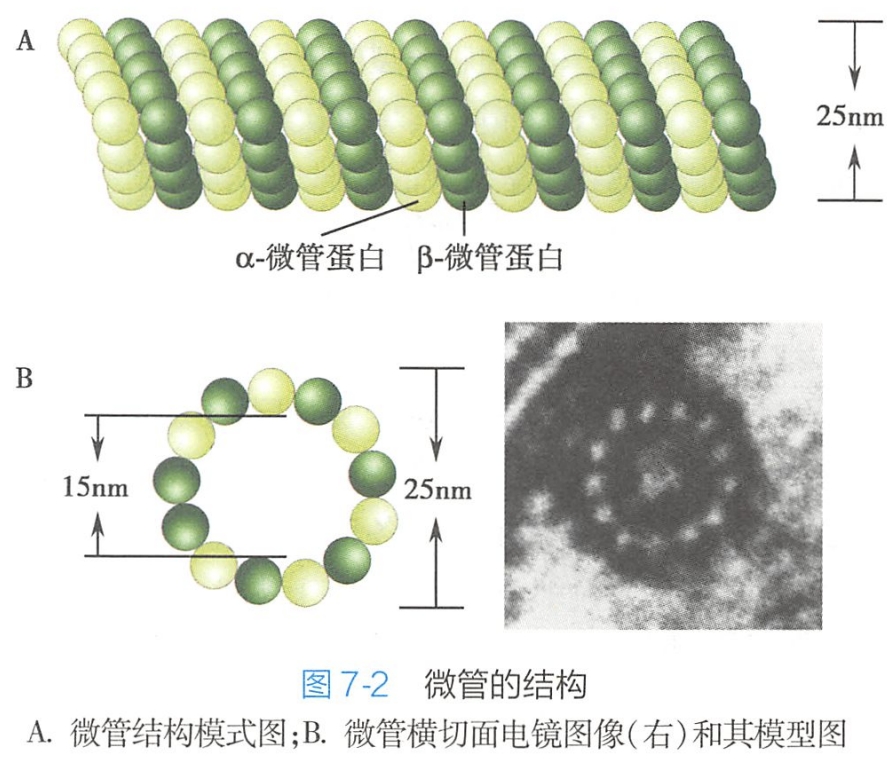
微管以微管蛋白α、β异二聚体为基本构件。
- 微管中微管蛋白二聚体头尾相接形成原纤维
- 再经过原纤维的两端和侧面增加二聚体扩展成为片层
- 当片层达到13根原纤维时即合拢成一段微管
- 然后新的异二聚体再不断增加到微管的两端使之不断延长。
微管具有极性,其两端的增长速度不同,增长速度快的一端为正端,另一端则为负端。微管极性的分布走向与细胞器定位分布、物质运输方向等微管功能密切相关。
(二)微管蛋白
微管由微管蛋白(也称管蛋白,tubulin)分子组成。微管蛋白的主要成分为α管蛋白(a-tubulin)和β管蛋白(B-tubulin),约占微管总蛋白含量的80%~95%。
近年来人们又发现了微管蛋白家族的第三个成员——γ微管蛋白,该成员定位于微管组织中心(microtubule organizing center,MTOC),对微管的形成、微管的数量和位置、微管极性的确定及细胞分裂起重要作用。
(三)微管存在形式
微管在细胞中有三种不同的存在形式:单管、二联管和三联管(图7-3)。
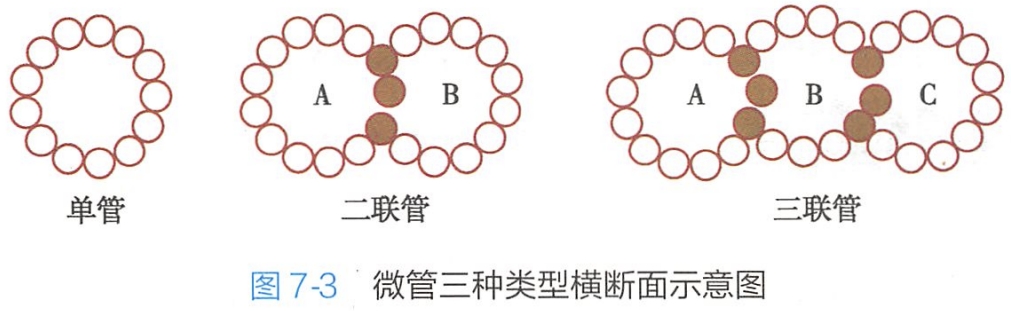
1.单管
单管由13根原纤维组成,是细胞质中主要的存在形式,分散或成束分布,但不稳定,易受低温、钙离子等因素的影响而发生解聚。
2.二联管
二联管由A、B两根单管组成,A管有13根原纤维,B管有10根原纤维,与A管共用3根原纤维,主要分布于纤毛和鞭毛内。
3.三联管
三联管由A、B、C三根单管组成,A管有13根原纤维,B管和C管均由 10根原纤维组成,分别与A管和B管共用3根原纤维,主要分布于中心粒及鞭毛和纤毛的基体中。二联管和三联管是比较稳定的微管结构。
二、微管结合蛋白
在细胞内,微管除了含有微管蛋白外,还含有一些同微管相结合的辅助蛋白,这些蛋白质总是与微管共存,参与微管的装配,称为微管结合蛋白(microtubule associated protein,MAP)。
它们不是构成微管壁的基本构件,而是在微管蛋白装配成微管之后,结合在微管表面的辅助蛋白。一般认为,微管结合蛋白由两个区域组成:
- 一个是碱性的微管结合区域,该结构域可与微管结合,可明显加速微管的成核作用;
- 另一个是酸性的突出区域,以横桥的方式与其他骨架纤维相连接,突出区域的长度决定微管在成束时的间距大小。
微管结合蛋白主要包括MAP-1、MAP-2、tau、MAP-4,前三种微管结合蛋白主要存在于神经元中。MAP-4在神经元和非神经元细胞中均存在,在进化上具有保守性。
不同的微管结合蛋白在细胞中有不同的分布区域,执行特殊功能。这在神经细胞中表现尤为突出:tau只存在于轴突中,而MAP-2则分布于胞体和树突中。
三、微管的装配与动力学
除了特化细胞的微管外,大多数微管都是不稳定的,能够很快地组装或去组装。
微管的装配主要表现为动态不稳定性(dynamic instability),即增长的微管末端有微管蛋白-GTP帽(tubulin-GTP cap),在微管组装期间或组装后GTP被水解成GDP,从而使GDP-微管蛋白成为微管的主要成分。
微管蛋白-GTP帽及短小的微管原纤维从微管末端脱落则使微管解聚。
微管的装配过程可分为三个时期:成核期、聚合期和稳定期。
- 成核期(nucleation phase)又称为延迟期(lag phase),在该期α、β微管蛋白聚合成短的寡聚体(oligmer)结构,即核心形成,接着二聚体在其两端和侧面增加使之扩展成片状带,当片状带加宽至13根原纤维时,即合拢成一段微管。由于该期是微管聚合的开始,速度较慢,为微管聚合的限速过程,因此称为延迟期。
- 聚合期(polymerization phase)又称延长期(elongation phase),该期中细胞内高浓度的游离微管蛋白聚合速度大于解聚速度,新的二聚体不断加到微管正端,使微管延长,直至游离的微管蛋白下降,解聚速度逐渐增加。
- 稳定期(steady state phase)又称为平衡期(equilibrium phase),胞质中游离的微管蛋白达到临界浓度,微管的组装(聚合)与去组装(解聚)速度相等。
(一)微管装配的起始点是微管组织中心
微管聚合从特异性的核心形成位点开始,这些核心形成位点主要是中心体和纤毛的基体,称为微管组织中心(图7-4)。
微管组织中心的主要作用是帮助大多数细胞质微管装配过程中的成核(nucleation),微管从微管组织中心开始生长,这是细胞质微管装配的一个独特的性质,即细胞质微管的装配受统一的功能位点控制。
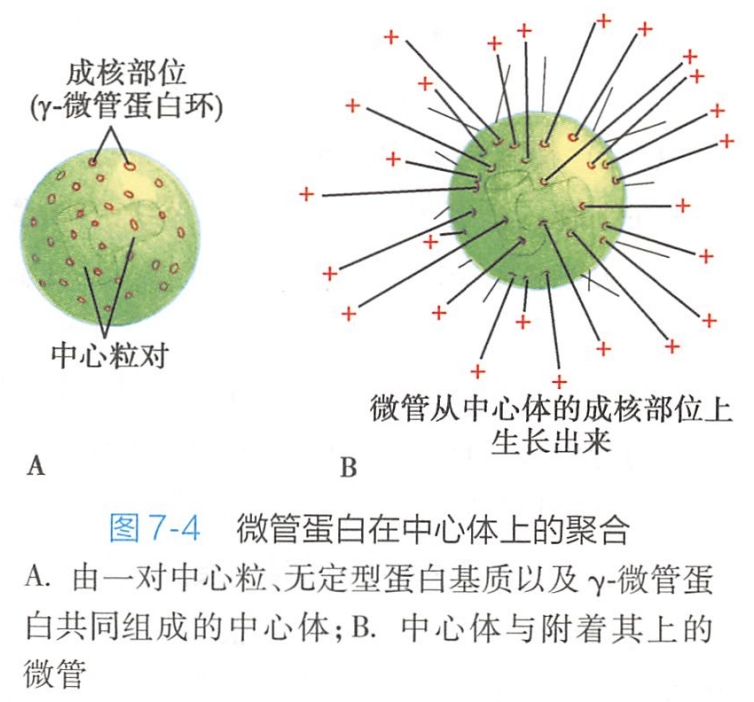
微管的核心形成是微管组装的限速过程。γ-微管蛋白环形复合体(γ-tubulin ring complex,y-TuRC)可形成一含有10~13个γ-微管蛋白分子的环形结构,与微管具有相同直径。体外研究表明,γ-微管蛋白复合体可刺激微管核心形成,并包裹微管负端,阻止微管蛋白的渗入。γ-微管蛋白复合体除影响微管的成核作用外,还可能影响微管从中心粒上释放。
中心体(cen trosome)是动物细胞中决定微管形成的一种细胞器,包括中心粒(centriole)和中心粒旁物质(pericentriolar material)。在细胞间期,位于细胞核的附近,在有丝分裂期,位于纺锤体的两极。如果用秋水仙素解聚微管再撤去药物使之重合,这时可清楚显示微管的发源。新生微管从中心体发出星形结构称为星状体(aster),继而伸长达到细胞的边沿,直到再形成原有的微管网架为止。
(二)微管的体外装配
在适当的条件下,微管能进行自我装配,其装配受到微管蛋白的浓度、pH和温度的影响。
微管动态不稳定性行为的发生需要水解GTP提供能量,因此,GTP是调节微管体外组装的主要物质。在影响微管聚合的主要条件中,尤以微管蛋白的浓度及GTP的存在最为重要。在体外,只要微管蛋白异二聚体达到一定的临界浓度(约为1mg/ml),在有Mg2+存在(无Ca2+)、适当的pH(pH6.9)和温度(37℃)的缓冲液中,异二聚体即聚合成微管。
同时需要由GTP提供能量,α/β-微管蛋白异二聚体同 GTP结合后而被激活,引起微管蛋白分子的构象呈直线型,从而使异二聚体聚合成微管,而GTP则分解为GDP和磷酸。
当微管蛋白的聚合迅速进行时,微管蛋白分子添加到微管上的速度大于它们所携带的GTP水解速度,因此新生成的微管上全是GTP-微管蛋白亚基。正因为GTP-微管蛋白亚基之间结合得比较牢固,结果在微管末端形成一个称为GTP帽的结构,它可防止微管的解聚。
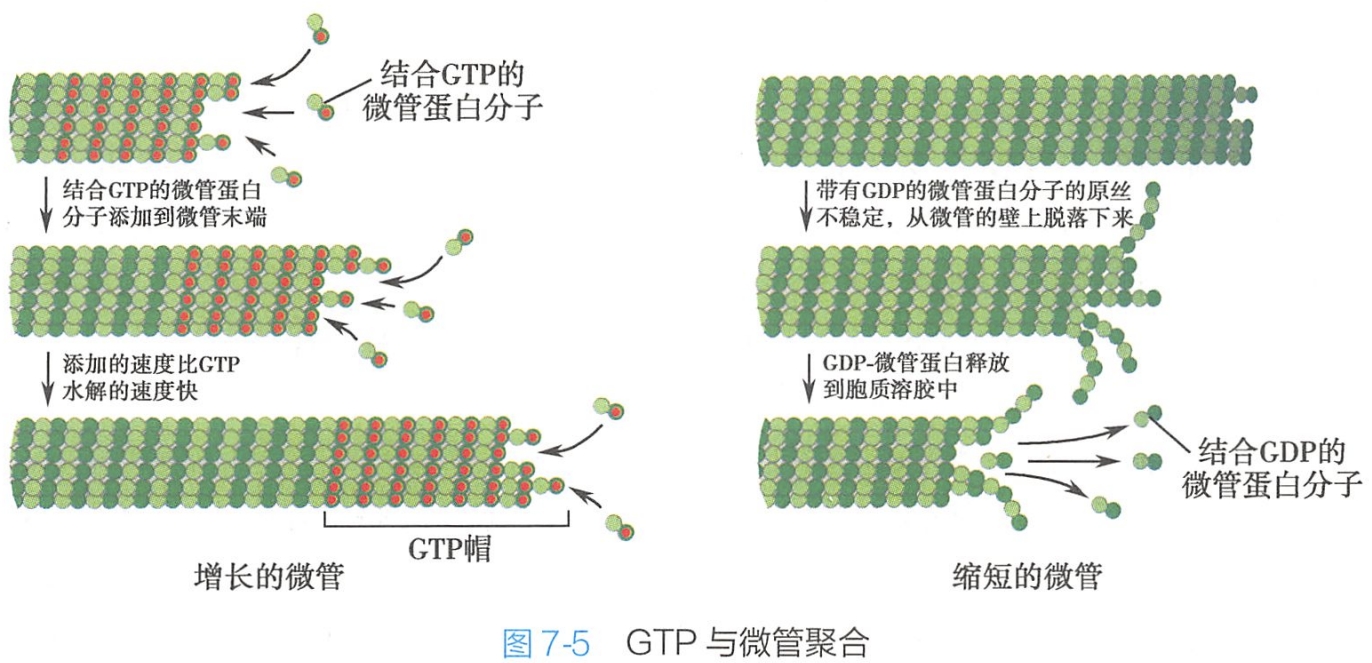
当微管生长较慢时,GTP帽中的亚基会在新的携带有GTP的亚基结合上来以前,就水解它自己的GTP成GDP,这样就失去GTP帽,携有GDP的亚基由于对微管聚合体的结合不紧密而很快从游离端上释放出来,这样微管就不停的缩短。
因此,当微管两端的微管蛋白具有GTP帽(与GTP结合)时,微管继续聚合;而具有GDP帽(与GDP结合)时,将改变异二聚体的构象使原纤维弯曲而不能形成微管的管壁,微管则趋向于解聚(图7-5)。
细胞内微管的这两种状态(聚合和解聚)是不断发生的,因为细胞内不断有微管解聚,又不断有新微管的聚合。
原纤维中异二聚体亚单位重复排列具有极性,使细胞内所有由微管构成的结构也具有极性。在一定条件下,微管两个端点的装配速度不同,表现出明显的极性。微管的一端发生GTP和微管蛋白的添加,使微管不断延长,称为正端;而在另一端具有GDP的微管蛋白发生解聚而使微管缩短,则为负端,微管的这种装配方式又称为踏车运动(treadmilling)。
(三)微管的体内装配
在细胞内微管形成时,γ-TuRC存在于微管组织中心,γ-TuRC就像一颗种子,成为更多异二聚体结合上去的核心,微管从此生长、延长。α/β微管蛋白异二聚体结合到γ-TuRC上,通过微管蛋白彼此间相互作用而稳定,形成一短的微管。由于γ-TuRC像帽子一样戴在微管的负端而使微管负端稳定。
γ-TuRC组织微管形成的能力可能受细胞周期调节的影响而开闭。最明显的模式是:在间期组织微管形成的能力被关闭,而在G2期到M期的转换时期,一种涉及细胞周期调节的激酶可能使γ-微管蛋白或γ-TuRC中的某些蛋白质磷酸化,从而开放γ-TuRC组织形成微管的能力。
(四)很多因素影响微管组装和解聚
造成微管不稳定性的因素很多,包括GTP浓度、压力、温度、pH、离子浓度、微管蛋白临界浓度、药物等。
有些微管特异性药物在微管结构与功能研究中起重要作用,这些药物主要有:紫杉醇(txol)、秋水仙素(cochicine)和长春新碱(vinblastine)等。紫杉醇能和微管紧密结合防止微管蛋白亚基的解聚,加速微管蛋白的聚合。与紫杉醇作用相反,秋水仙素能结合和稳定游离的微管蛋白,使它无法聚合成微管,引起微管的解聚。长春新碱能结合微管蛋白异二聚体,抑制它们的聚合作用。
四、微管的功能
(一)微管构成细胞内的网状支架,支持和维持细胞的形态
维持细胞形态是微管的基本功能。微管本身不能收缩,但具有一定的强度,能够抗压和抗弯曲,这种特性给细胞提供了机械支持力。
例如在血小板中有一束微管环形排列于血小板周围,维持血小板的圆盘形结构。另外,微管对于细胞突起部分,如纤毛、鞭毛、轴突的形成和维持也具有重要作用。
(二)微管参与中心粒、纤毛和鞭毛的形成
在光学显微镜下,中心体位于细胞核附近,由中心粒和中心粒周围物质共同组成。在电镜下,中心粒是由9组三联体微管(9×3)围成的一个圆筒状结构,在各种细胞中基本相同。中心体是动物细胞中主要的微管组织中心。
在细胞分裂间期,中心体形成胞质微管,构成细胞骨架的主要纤维系统,一方面作为细胞内物质运输的轨道基础,另一方面对细胞形状的维持和改变也起到必不可少的作用;在M期,经过复制的中心体形成纺锤体的两极,指导有丝分裂事件的进行,与纺锤丝的排列和染色体的移动有密切关系。
纤毛(cilia)和鞭毛(flagella)具有运动功能,用来划动其表面的液体,是细胞表面的特化结构。纤毛和鞭毛在来源和结构上基本相同。所不同的是,就一个细胞而论,纤毛短而多,而鞭毛则长而少。纤毛和鞭毛都是以微管为主要成分构成的,并且有特殊的结构形式,大多数属于9×2+2类型。
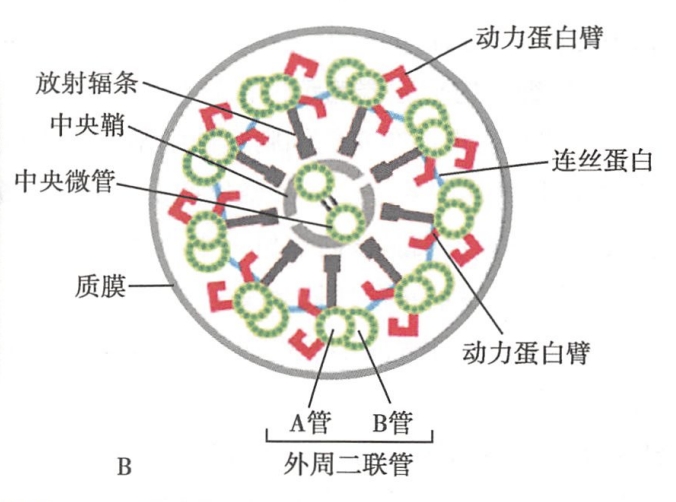
纤毛和鞭毛的横断面电镜观察可见中央有两条微管,称为中央微管。中央微管的外周包围一层蛋白性质的鞘,称为中央鞘(central sheath)。外周则以9组二联管围绕。二联管两两之间以微管连接蛋白相连。外周二联管和中央鞘之间也有连接,称为放射辐条(radial spoke)。放射辐条由A管伸出,近中央鞘一端膨大,称为辐头。A管上还伸出动力蛋白臂(dynein arm),其头部具有ATP酶活性,可为纤毛与鞭毛的运动提供动力。鞭毛与纤毛的基体(basal body)由三联管组成,与中心粒相似。基体的中央无微管(图7-6)。
纤毛和鞭毛的运动是一种简单的弯曲运动,其运动机制一般用微管滑动模型解释:
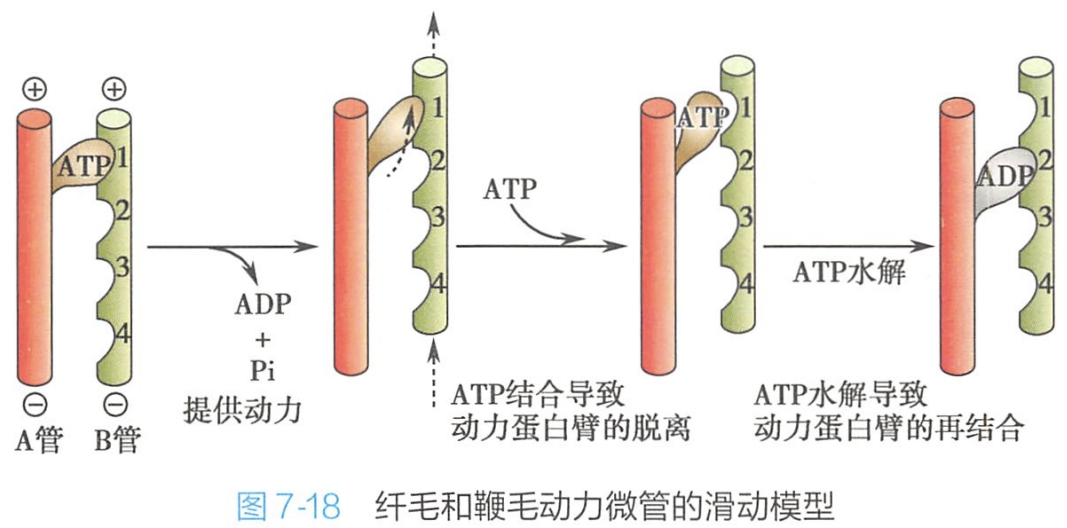
- 动力蛋白头部与相邻二联管的B微管接触,促进与动力蛋白结合的ATP水解,并释放ADP和Pi,改变了A微管动力蛋白头部的构象,促进头部朝向相邻二联管的正极滑动,使相邻二联管之间产生弯曲力;
- 新的ATP结合,促使动力蛋白头部与相邻B管脱离;
- ATP水解,其放出的能量使动力蛋白头部的角度复原;
- 带有水解产物的动力蛋白头部与相邻二联管上的另一个位点结合,开始下一个循环(图7-18)。(这样实际上动一次消耗2ATP)
单个细胞的移动方式有多种,极少数细胞通过纤毛和鞭毛进行运动,如纤毛虫借助纤毛进行移动和摄取食物,精子依靠鞭毛的摆动在液体中游动。但绝大多数动物细胞是通过爬行的方式在细胞外基质或固体表面上运动。
(三)微管参与细胞内物质运输
微管在核的周围分布密集,并向胞质外周伸展。在线粒体周围也有微管的存在,有的微管直接连到高尔基复合体小泡上;核糖体可系在微管和微丝的交叉点上。
所以,细胞内的细胞器移动和胞质中的物质转运都和微管有着密切的关系。例如,神经细胞合成的蛋白质等物质沿神经轴索快速运送至远端的神经末梢,细胞的分泌颗粒和色素细胞的色素颗粒沿微管运输,线粒体的快速运动也是沿微管进行的。
微管参与细胞内物质运输的任务主要由微管马达蛋白(motor protein)来完成,马达蛋白是指介导细胞内物质沿细胞骨架运输的蛋白(图7-7)。
目前发现有几十种马达蛋白,可以归属于三大家族:
- 动力蛋白(dynein)家族:微管
- 驱动蛋白(kinesin)家族:微管
- 肌球蛋白(myosin)家族:微丝
其中驱动蛋白和动力蛋白是以微管作为运行轨道,而肌球蛋白则是以肌动蛋白纤维作为运行轨道。
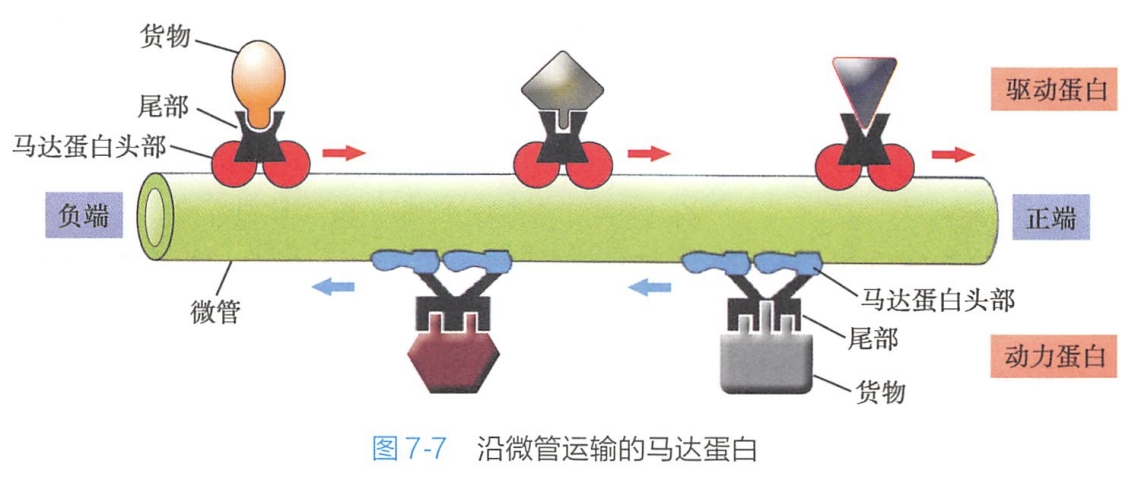
胞质动力蛋白和驱动蛋白各有两个球状ATP结合头部和一个尾部,其头部与微管是以空间结构专一的方式结合的,因此只有当驱动蛋白和动力蛋白以正确的姿势“指向”微管时才能结合上去;而马达蛋白(驱动蛋白和动力蛋白)的尾部通常是与细胞组分如小泡或细胞器稳定结合的,因此也就决定了马达蛋白所运载的“货物”种类。驱动蛋白和动力蛋白的头部是具有ATP水解活性的酶(ATP酶),这一酶解反应所产生的能量可提供这两者的头部作一个循环的构象改变,完成一套与微管结合、解离、再结合的动作,从而使蛋白沿着微管移动。
驱动蛋白是一类微管激活的ATP酶,可沿微管由负端向正端移动,在胞内物质运输中具有重要作用。在神经细胞中,驱动蛋白已被证明沿着轴突的微管“轨道”负责快速轴突运输,线粒体快速移动,分泌小泡前体和各种轴突组成物运输到达神经末梢。
动力蛋白是一个由9~12个亚基组成的蛋白质复合体,具有ATP酶活性,可沿微管由正端向负端移动,为细胞内物质运输和纤毛运动提供动力。间期细胞中胞质动力蛋白的一个主要作用是参与细胞器的定位和转运。
(四)微管维持细胞内细胞器的定位和分布
微管及其相关的马达蛋白在真核细胞膜性细胞器的定位上起着重要作用。细胞中线粒体的分布与微管相伴随,游离核糖体附着于微管和微丝的交叉点上,微管使内质网在细胞质中展开分布,使高尔基复合体在细胞中央靠近细胞核而定位于中心体附近。如果用秋水仙素处理细胞,破坏微管的装配,那么这些细胞器的有序空间排列就会改变,如内质网坍塌,由于内质网与核被膜相联系,于是便积聚到核附近;高尔基复合体分解成小的囊泡,分散在整个细胞质中。当把秋水仙素去除以后,则细胞器的分布重新恢复正常。
(五)微管参与染色体的运动,调节细胞分裂
微管是构成有丝分裂器的主要成分,可介导染色体的运动。有丝分裂前期,染色体的动粒(kie- tochore)出现并逐渐成熟,当核膜开始崩解时,微管侵入核区,染色体一端的动粒可捕获从纺锤体极伸出的微管,形成侧位连接,并沿着单根微管的侧面向极区方向滑动。由于极区的微管密集,这一运动使动粒容易获得更多的微管。这些微管与动粒形成端位连结,并通过在动粒一端的聚合延伸而推动染色体向纺锤体中部移动。同时另一侧姐妹染色单体上的动粒也与来自另一极的微管结合。有丝分裂后期只有在所有染色体都达到赤道板平衡后才会开始,任何一个染色体未与微管连接或未达到平衡位置,分裂后期都将被延迟。
(六)微管参与细胞内信号传导
已证明微管参与hedgehog、JNK、Wnt、ERK及PAK蛋白激酶信号转导通路。信号分子可直接与微管作用或通过马达蛋白和一些支架蛋白来与微管作用。微管的信号转导功能具有重要的生物学作用,它与细胞的极化、微管的不稳定动力学行为、微管的稳定性变化、微管的方向性及微管组织中心的位置均有关。