-
内膜系统:
其主要包括:内质网、高尔基复合体、溶酶体、各种转运小泡以及核膜等功能结构+过氧化物酶体
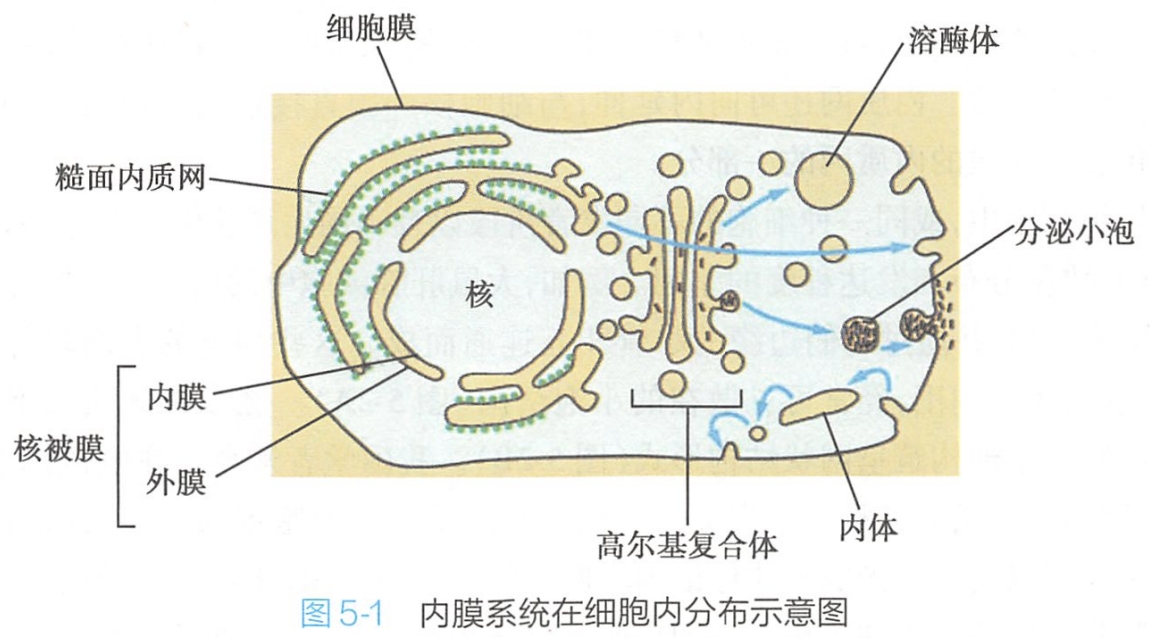
-
膜性细胞器:
-
内质网(endoplasmic reticulum,ER):内质网广泛分布于除成熟红细胞以外的所有真核细胞的胞质中。内质网还可向内延伸,与细胞核外膜直接连通。
- 分类
- 糙面内质网(ough endoplasmic reticulum,RER):主要形态特征是表面有核糖体附着,又称颗粒内质网(granular endoplasmic reticulum,GER)。在结构形态上,糙面内质网多呈排列较为整齐的扁平囊状;在功能上,糙面内质网主要和外输性蛋白质及多种膜蛋白的合成、加工及转运有关。因此,在具有肽类激素或蛋白分泌功能的细胞中,粗面内质网高度发达。
- 功能:蛋白质的合成、加工修饰、分选及转运
- 分泌性蛋白质,如肽类激素、细胞因子、抗体、消化酶、细胞外基质蛋白等:
- 分泌性蛋白质在糙面内质网的合成过程:细胞中所有蛋白质的合成,皆起始于细胞质基质中游离的核糖体上。分泌性蛋白多肽链在其合成起始后不久,随核糖体一起附着于糙面内质网上,不断延伸的多肽链穿过内质网膜直至肽链合成完成。
- 信号肽是指导蛋白多肽链在糙面内质网上合成与穿膜转移的决定因素:指导蛋白多肽链在糙面内质网上进行合成的决定因素,是被合成肽链N-端的一段特殊氨基酸序列,即信号肽(signal peptide,signal sequence)。
除了信号肽的指导性作用之外,核糖体与内质网的结合以及肽链穿越内质网膜的转移,还有赖于细胞质基质中信号识别颗粒(signal recognition particle,SRP)的介导和内质网膜上的信号识别颗粒受体(SRP-receptor,SRP-R)以及被称之为转运体(translocon,translocator)的易位蛋白质(亦称易位子)之协助。这一过程的基本步骤如下:- 新生分泌性蛋白质多肽链在细胞质基质中的游离核糖体上起始合成。当新生肽链N端的信号肽被翻译后,可立即被细胞质基质中的SRP识别、结合。所谓SRP是由6个多肽亚单位和1个沉降系数为7S的小分子RNA构成的复合体(图5-7A)。其一端与被翻译后的信号肽结合,另一端则结合于核糖体上,从而形成SRP-核糖体复合结构,并可使得翻译暂时终止,肽链的延长受到阻遏。
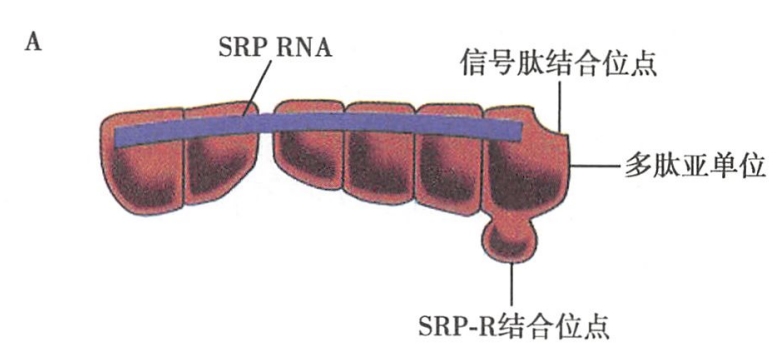
- 与信号肽结合的SRP识别、结合内质网膜上的SRP-R,并介导核糖体锚泊附着于内质网膜的转运体易位蛋白上。而SRP则从信号肽-核糖体复合体上解离,返回细胞质基质中重复上述过程。此时,暂时被阻遏的肽链延伸又继续进行(图5-7B)。 SRP-R是内质网的一种膜整合蛋白。由于该蛋白能够通过与SRP的识别而使得核糖体结合附着于内质网上,因此也称之为停靠蛋白质(docking protein)或船坞蛋白质。
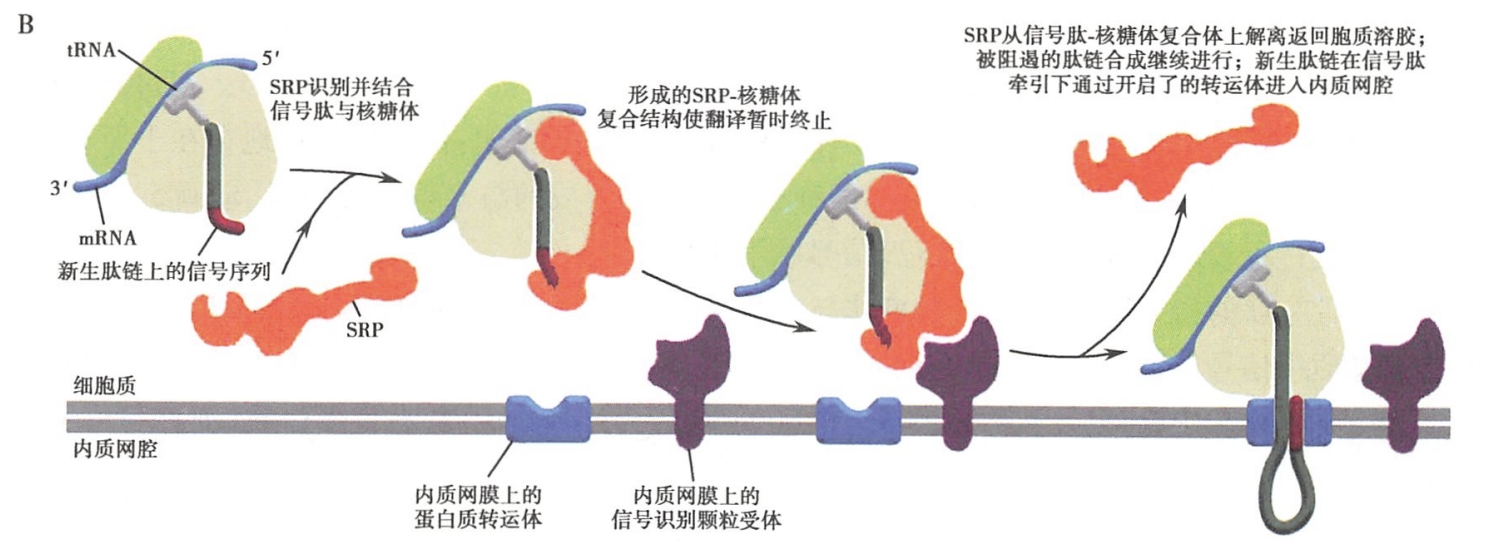
- 在信号肽的引导下,合成中的肽链,通过由核糖体大亚基的中央管和转运体的易位蛋白共同形成的通道,穿膜进入内质网网腔。随之,信号肽序列被内质网膜腔面的信号肽酶切除,新生肽链继续延伸,直至完成而终止。最后,完成肽链合成的核糖体大、小亚基解聚,并从内质网上解离(图 5-7C)。
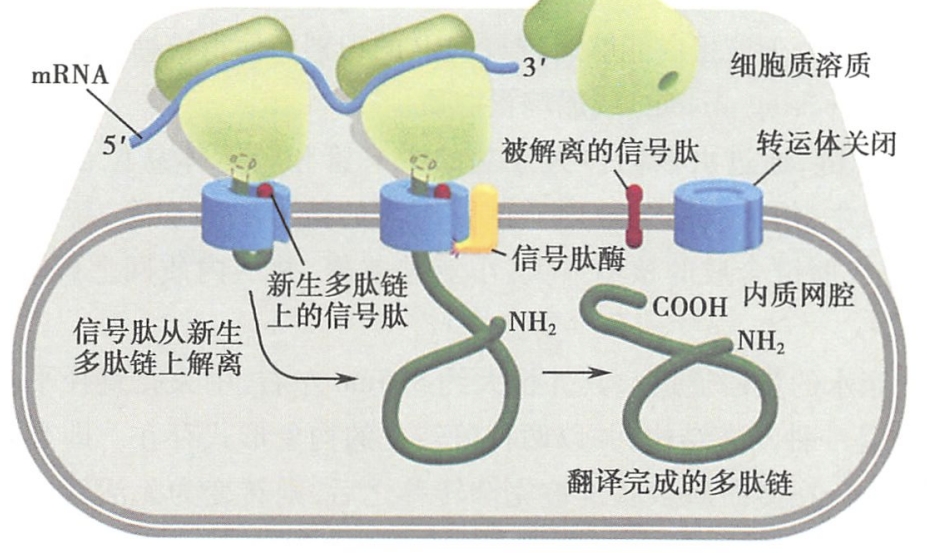
- 新生分泌性蛋白质多肽链在细胞质基质中的游离核糖体上起始合成。当新生肽链N端的信号肽被翻译后,可立即被细胞质基质中的SRP识别、结合。所谓SRP是由6个多肽亚单位和1个沉降系数为7S的小分子RNA构成的复合体(图5-7A)。其一端与被翻译后的信号肽结合,另一端则结合于核糖体上,从而形成SRP-核糖体复合结构,并可使得翻译暂时终止,肽链的延长受到阻遏。
- 新生多肽链的折叠与装配:多肽链的氨基酸组成和排列顺序,决定了蛋白质的基本理化性质;而蛋白质功能的实现,却直接依赖于多肽链依其特定的方式盘旋、折叠所形成的高级三维空间结构。内质网为新生多肽链的正确折叠和装配提供了有利的环境。
- 在内质网腔中,丰富的氧化型谷胱甘肽(GSSG),是有利于多肽链上半胱氨酸残基之间二硫键形成的必要条件;附着于网膜腔面的蛋白二硫键异构酶,则使得二硫键的形成及多肽链的折叠速度大大地加快。
- 存在于内质网中的免疫球蛋白重链结合蛋白(BP)、内质蛋白、钙网蛋白及钙连蛋白等,均能够与折叠错误的多肽和尚未完成装配的蛋白亚单位识别结合,并予以滞留,同时还可促使它们的重新折叠、装配与运输。因此将这类能够帮助多肽链转运、折叠和组装的结合蛋白称做“伴侣”蛋白(chaperone protein)或“分子伴侣”(molecular chaperone)一因它们虽然能够通过与多肽链的识别结合来协助它们的折叠组装和转运,但其本身却并不参与最终产物的形成而得名。
- 蛋白质的糖基化:是指单糖或者寡糖与蛋白质之间通过共价键的结合形成糖蛋白的过程。由附着型核糖体合成并经由内质网转运的蛋白质,其中大多数都要被糖基化。
-
发生在糙面内质网中的糖基化主要是寡糖与蛋白质天冬酰胺残基侧链上氨基基团的结合,所以亦称之为N-连接糖基化(N-linked glycosylation)。催化这一过程的糖基转移酶是存在于糙面内质网网膜腔面的一种膜整合蛋白质。
-
发生在内质网中的蛋白质N-连接糖基化修饰,均开始于一个共同的前体——一种由N-乙酰葡萄糖胺、甘露糖和葡萄糖组成的14寡糖。寡糖首先与内质网膜中的嵌入脂质分子磷酸多萜醇连接并被其活化
-
然后在糖基转移酶的催化下转移连接到新生肽链中特定三肽序列Asn-X-Ser或Asn-X-Thr(X代表除Pro之外的任何氨基酸)的天冬酰胺残基上。
-
- 蛋白质的胞内运输:由附着型核糖体合成的各种外输性蛋白质,经过在糙面内质网中的修饰、加工后,最终被内质网膜包裹,并以“出芽”的方式形成膜性小泡而转运。除信号肽等信号序列之外,信号斑(signal patch)也是重要的蛋白质分选转运信号。信号斑是指新生蛋白质多肽链合成后折叠时,在其表面由特定氨基酸序列形成的三维功能结构。
- 第一条途径是经过在内质网腔的糖基化等作用,以转运小泡的形式进入高尔基复合体,进一步加工浓缩并最终以分泌颗粒的形式被排吐到细胞之外。这也是最为普遍和最为常见的蛋白分泌途径。
- 第二条途径仅见于某些哺乳动物的胰腺外分泌细胞,其大致过程是:来自糙面内质网的分泌蛋白以膜泡形式直接进入一种大浓缩泡,进而发育成酶原颗粒,然后被排出细胞。通过上述两条不同途径,可见蛋白质分泌的共同特点,即所有分泌蛋白的胞内运输过程,始终是以膜泡形式完全隔离于细胞质基质进行转运的。
- 信号肽是指导蛋白多肽链在糙面内质网上合成与穿膜转移的决定因素:指导蛋白多肽链在糙面内质网上进行合成的决定因素,是被合成肽链N-端的一段特殊氨基酸序列,即信号肽(signal peptide,signal sequence)。
- 分泌性蛋白质在糙面内质网的合成过程:细胞中所有蛋白质的合成,皆起始于细胞质基质中游离的核糖体上。分泌性蛋白多肽链在其合成起始后不久,随核糖体一起附着于糙面内质网上,不断延伸的多肽链穿过内质网膜直至肽链合成完成。
- 膜整合蛋白质,如膜抗原、膜受体等
- 细胞器中的驻留蛋白(retention protein),像定位于糙面内质网、光面内质网、高尔基复合体、溶酶体等各种细胞器中的可溶性驻留蛋白。
- 游离核糖体合成的蛋白质:如果待合成蛋白质N端无信号肽,那么它们将继续在胞质中的游离核糖体上合成,直至合成结束。通过这种方式合成的胞内蛋白包括:
- 分泌性蛋白质,如肽类激素、细胞因子、抗体、消化酶、细胞外基质蛋白等:
- 功能:蛋白质的合成、加工修饰、分选及转运
- 光面内质网(smooth endoplasmic reticulum,SER):表面光滑的管泡样网状形态结构,也称无颗粒内质网(agranular endoplasmic reticulum,AER)。常常可见与粗面内质网相互连通。
- 功能:
- 光面内质网参与脂质的合成和转运:脂肪的合成、类固醇的代谢是在光面内质网中进行的。经由小肠吸收的脂肪分解物甘油、甘油一酯和脂肪酸,进入细胞之后,在内质网中可被重新合成为甘油三酯。
- 甘油三酯合成:一般认为,在光面内质网合成的脂类常常会与糙面内质网来源的蛋白质结合形成脂蛋白,然后经由高尔基复合体分泌出去。比如,在正常肝细胞中合成的低密度脂蛋白(LDL)和极低密度脂蛋白(VLDL)等物质,被分泌后可携带、运输血液中的胆固醇和甘油三酯以及其他脂类到脂肪组织。如果阻断脂蛋白经由高尔基复合体的运输途径,就会造成脂类在内质网中的积聚引起脂肪肝。
- 膜脂合成:除线粒体特有的两种磷脂外,细胞所需要的全部膜脂几乎都是由内质网合成的。内质网脂质合成的底物来源于细胞质基质;催化脂质合成的相关酶类是定位于内质网膜上的膜镶嵌蛋白;脂质合成起始并完成于内质网膜的胞质侧,其主要过程是: #!
- 首先是脂酰基转移酶(acyl transferase)催化脂酰辅酶A(fatty acyl CoA)与甘油-3-磷酸反应,把2个脂肪酸链转移、结合到甘油-3-磷酸分子上形成磷脂酸(phosphatidic acid);
- 继而在磷酸酶的作用下,使磷脂酸去磷酸化生成双酰甘油;
- 然后,再由胆碱磷酸转移酶(choline phosphotransferase)催化,在双酰甘油上添加结合一个极性基团,最终形成由一个极性头部基团和两条脂肪酸链疏水尾部构成的双亲性脂类分子。通过以上过程合成的极性甘油二脂双亲媒性脂类物质,借助于翻转酶(flippase)的作用,很快被转向内质网腔面;最终再被输送到其他的膜上。
- 脂质由内质网向其他膜结构的转运主要有两种形式:
- 以出芽小泡的形式转运到高尔基复合体、溶酶体和质膜。
- 以水溶性的磷脂交换蛋白(phospholipid exchange protein,PEP)作为载体,与之结合形成复合体进入细胞质基质,通过自由扩散,到达缺少磷脂的线粒体和过氧化物酶体膜上。体外实验显示:每一种磷脂交换蛋白只能专一性地识别一种磷脂,以单分子形式,从内质网膜提取并进行膜间的磷脂分子载运转移。
- 光面内质网参与糖原的代谢:内质网参与了糖原的分解过程。肝细胞中光面内质网上存在与碳水化合物代谢反应功能相关的酶类,主要包含葡萄糖-6-磷酸酶、β-葡萄糖醛酸酶、葡萄糖醛酸转移酶和GDP甘露糖基转移酶等。
- 在肝细胞光面内质网胞质面附着的糖原颗粒可被糖原磷酸化酶(glycogenphosphorylase)降解,形成1-磷酸葡萄糖。
- 然后在细胞质溶胶中的磷酸葡萄糖变位酶(phosphoglucomutase)的作用下转化为6-磷酸葡萄糖。
- 最后,被光面内质网网腔面上的葡萄糖-6-磷酸酶催化,发生去磷酸化;去磷酸化后的葡萄糖,更易于透过脂质双层膜,然后经由内质网被释放到血液中。
- 至于内质网是否也参与了糖原的合成过程,目前还存在着截然不同的两种观点。
- 认为内质网参与糖原合成的观点指出:在肝细胞中,糖原颗粒常与光面内质网伴存,当糖原颗粒量多时,光面内质网被遮盖而不易辨认;在动物被禁食几天后,糖原减少,光面内质网明显,提示糖原的合成似与光面内质网有关。
- 但另一些研究发现,光面内质网上无催化糖原合成的糖原合酶(glycogen synthase),糖原合酶的功能是催化尿苷二磷酸葡萄糖(UDPG)中的葡萄糖基与糖原引物的非还原端分支上的葡萄糖基聚合,从而延长糖链;UDPG并不与内质网膜结合,而是结合在糖原颗粒上。此外,如果把UDPG加到引物糖原上,便可参与糖原的合成。这说明糖原的合成与光面内质网无关。
- 光面内质网是细胞解毒的主要场所:肝脏是分解解毒的主要器官。肝脏的解毒作用主要由肝细胞中的光面内质网完成。其含有丰富的氧化及电子传递酶系,包括细胞色素P450、NADPH-细胞色素P450还原酶、细胞色素b5、NADH-细胞色素b5还原酶、NADPH-细胞色素c还原酶等。
- 其解毒的基本机制是:在电子传递的氧化还原过程中,通过催化多种化合物的氧化或羟化
- 一方面,使得毒物、药物的毒性作用被钝化或者破坏;
- 另一方面,则由于羟化作用而增强了化合物的极性,使之更易于排泄。
- 当然,这种氧化作用也可能会使某些物质的毒性增强。
- 内质网电子传递链与线粒体电子传递链的不同之处是:
- 其一,链的组成比线粒体较短;
- 其二,它所催化的反应,实质上都是在作用物分子中加入一个氧原子。因此,有人也把内质网电子传递链酶系称作羟化酶或加单氧酶(monooxygenase)系。还有人称之为混合功能氧化酶(mixed function oxidase)。
- 其解毒的基本机制是:在电子传递的氧化还原过程中,通过催化多种化合物的氧化或羟化
- 光面内质网是肌细胞Ca2+的储存场所:肌细胞中,十分发达的光面内质网特化为一种特殊的结构——肌质网。通常状况下,肌质网网膜上的钙泵把细胞质基质中的Ca2+泵入网腔储存起来;当受到神经冲动的刺激或者细胞外信号物质的作用时,即可引起Ca2+向细胞质基质的释放。在肌质网腔中存在的钙结合蛋白浓度为30~100mg/ml;每个钙结合蛋白分子可与30个左右的 Ca2+结合,这就使得内质网中的Ca2+浓度高达3mmol/L。内质网中高浓度的Ca2+和钙离子结合蛋白的存在,还能够阻止内质网运输小泡的形成。
- 光面内质网与胃酸、胆汁的合成与分泌密切相关:在胃壁腺上皮细胞中,光面内质网可使 Cl-与H+结合生成HCl。在肝细胞中,光面内质网不仅能够合成胆盐,而且,可通过葡萄糖醛酸转移酶的作用,使非水溶性的胆红素颗粒形成水溶性的结合胆红素。
- 光面内质网参与脂质的合成和转运:脂肪的合成、类固醇的代谢是在光面内质网中进行的。经由小肠吸收的脂肪分解物甘油、甘油一酯和脂肪酸,进入细胞之后,在内质网中可被重新合成为甘油三酯。
- 功能:
- 内质网的衍生结构:比如,见于视网膜色素上皮细胞中的髓样体(myeloid body)、出现于生殖细胞、快速增殖细胞、某些哺乳类动物的神经元和松果体细胞以及一些癌细胞中的孔环状片层体(annulate lamellae)等。
- 糙面内质网(ough endoplasmic reticulum,RER):主要形态特征是表面有核糖体附着,又称颗粒内质网(granular endoplasmic reticulum,GER)。在结构形态上,糙面内质网多呈排列较为整齐的扁平囊状;在功能上,糙面内质网主要和外输性蛋白质及多种膜蛋白的合成、加工及转运有关。因此,在具有肽类激素或蛋白分泌功能的细胞中,粗面内质网高度发达。
- 化学组成
- 脂类
- 蛋白:
- 酶:葡萄糖-6-磷酸酶为主要标志酶
- 网质蛋白:网质蛋白(reticulo-plasmin)普遍存在于内质网网腔。它们的共同特点是在其多肽链的羧基端(C端)均含有一个KDEL(Lys-Asp-Glu-Lu,即赖氨酸-天冬氨酸-谷氨酸-亮氨酸)或 HDEL(His-Asp-Glu-Leu,即组氨酸-天冬氨酸-谷氨酸-亮氨酸)的4氨基酸序列驻留信号(retention signal)。网质蛋白可通过驻留信号与内质网膜上相应受体的识别结合而驻留于内质网腔不被转运。 #?
- 免疫球蛋白重链结合蛋白:一类与热激蛋白70(heat shock protein70,Hsp70)同源的单体非糖蛋白。它们具有阻止蛋白质聚集或发生不可逆变性,并协助蛋白质折叠的重要作用。
- 内质蛋白:内质蛋白(endoplasmin)又称葡萄糖调节蛋白94(glucose regulated protein94)。作为内质网标志性的分子伴侣,被蛋白酶激活后,可参与新生肽链的折叠和转运。而与钙离子的结合,则可能是其所具有的多种重要功能之一。
- 钙网蛋白:钙网蛋白(calreticulin)具有一个高亲和性和多个低亲和性的钙离子结合位点,表现出许多与肌质网中集钙蛋白(calsequestrin)共同的特性。其在钙平衡调节、蛋白质折叠和加工、抗原呈递、血管发生及凋亡等生命活动过程中发挥重要的生物学功能作用。
- 钙连蛋白:钙连蛋白(calnexin)是一种钙离子依赖的凝集素样伴侣蛋白。它们能够与未完成折叠的新生蛋白质的寡糖链结合,以避免蛋白质彼此的凝集与泛素化(ubiquitination);阻止折叠尚不完全的蛋白质离开内质网,并进而促使其完全折叠。
- 蛋白质二硫键异构酶:存在于内质网腔中的蛋白质二硫键异构酶(protein disulfide isomerase, PD)可通过催化蛋白质中二硫键的交换以保证蛋白质的正常折叠。
- 分类
-
-
核膜
-
囊泡
-